Sa 16.04.2022 — Inge Schuster

![]() Als vor nun bereits mehr als zwei Jahren die ersten COVID-19 Fälle auftraten, wurden diese primär als schwere, einen hohen Todeszoll fordernde Erkrankung der Atemwege klassifiziert. Mittlerweise gibt es weltweit mehr als eine halbe Milliarde bestätigte SARS-CoV-2 Infizierte (und knapp 6,2 Millionen daran Verstorbene) und es ist offensichtlich, dass das Virus auch in anderen Organen Schäden anrichten und Langzeitfolgen - long Covid - nach sich ziehen kann. Darunter fallen neurologische Beschwerden, deren Pathogenese noch wenig verstanden ist. Modelluntersuchungen an infizierten Affen, die milde bis moderate Atemwegserkrankungen entwickeln, aber vergleichbare neuropathologische Befunde in Hirngeweben wie an COVID-19 verstorbene Patienten aufweisen, geben erste Einblicke in die Virus-ausgelösten Entzündungsprozesse, die in vielen Hirnregionen auftreten und Schädigung und Absterben von Nervenzellen bewirken können.
Als vor nun bereits mehr als zwei Jahren die ersten COVID-19 Fälle auftraten, wurden diese primär als schwere, einen hohen Todeszoll fordernde Erkrankung der Atemwege klassifiziert. Mittlerweise gibt es weltweit mehr als eine halbe Milliarde bestätigte SARS-CoV-2 Infizierte (und knapp 6,2 Millionen daran Verstorbene) und es ist offensichtlich, dass das Virus auch in anderen Organen Schäden anrichten und Langzeitfolgen - long Covid - nach sich ziehen kann. Darunter fallen neurologische Beschwerden, deren Pathogenese noch wenig verstanden ist. Modelluntersuchungen an infizierten Affen, die milde bis moderate Atemwegserkrankungen entwickeln, aber vergleichbare neuropathologische Befunde in Hirngeweben wie an COVID-19 verstorbene Patienten aufweisen, geben erste Einblicke in die Virus-ausgelösten Entzündungsprozesse, die in vielen Hirnregionen auftreten und Schädigung und Absterben von Nervenzellen bewirken können.
Mehr als 30 % der hospitalisierten Patienten aber auch Personen mit milden Krankheitssymptomen und sogar asymptomatische Infizierte können ein weites Spektrum an neurologischen Beschwerden entwickeln, die häufig als unspezifisch, vielleicht sogar als eingebildet angesehen werden. Neben - zum Teil dauerhaften - Störungen des Geruchs- und Geschmacksinns sind dies u.a. kognitive Probleme, Konzentrationsstörungen ("Gehirnnebel"), dauernde Erschöpfung, Schlafstörungen und persistierende Kopfschmerzen. Am Ende des Spektrums stehen zweifelsfreie Diagnosen von Schlaganfällen, Gehirn- und Gehirnhautentzündungen (Enzephalitis, Meningitis) und dem Guillain-Barré Syndrom (Zerstörung der Myelinummantelung von peripheren Nerven durch überschießende Immunreaktion); mehrere Studien berichten auch über Parkinsonerkrankungen, die zwei bis fünf Wochen nach der Infektion auftraten.
Als Reaktion auf das Virus, kann die Immunantwort - selbst wenn das Virus nicht mehr nachweisbar ist - zu weiteren Entzündungsprozessen im Gehirn führen und Schädigungen von Gefäßen, Zellen und Funktionen, insbesondere der neuronalen Signalübertragung verursachen. Dies geht aus Untersuchungen hervor, die an Hirngeweben von an COVID-19 verstorbenen Patienten ausgeführt wurden: einerseits konnte das Virus und seine Genprodukte in Hirnarealen nachgewiesen werden, andererseits wurden - auch wenn das Virus dort nicht (mehr) detektierbar war - Entzündungen festgestellt, die zu undichten Blutgefäßen und Gerinnseln führten (dazu im ScienceBlog: [1, 2]). Die Pathogenese der neurologischen Symptome blieb allerdings weiterhin unklar.
Neue Befunde
In den letzten Tagen sind einige Studien erschienen, die das Verstehen der neuropathologischen Konsequenzen von COVID-19 erheblich verbessert haben. Untersuchungen zu ultrastrukturellen Veränderungen des Riechtrakts können erstmals die Schwächung des Riechsystems bis hin zum persistierenden vollständigen Geruchsverlust erklären [3]. An relevanten Modellen - nicht-menschlichen Primaten - konnte der Infektionsprozess verfolgt und damit erstmals eine umfassende Beschreibung der durch SARS-CoV-2 Infektion ausgelösten Neuropathologie möglich werden [4, 5]. In den Gehirnen von SARS-CoV-2 infizierten nicht-menschlichen Primaten wurden zudem Aggregate von alpha-Synuclein gefunden, einem Charakteristikum der Parkinsonerkrankung [5]. Dazu passend haben in vitro-Untersuchungen ergeben, dass das Nukleocapsid-Protein des Virus (das in Hirnarealen von Patienten nachgewiesen wurde [1]) mit dem für die neuronale Funktion wichtigen alpha-Synuclein interagiert und die Bildung zelltoxischer Faserbündel auslöst [6].
Wesentliche Ergebnisse dieser Studien werden im Folgenden skizziert.
Neuropathologische Veränderungen im Riechsystem
Neben den Beeinträchtigungen der Atemwege gehören Riech -und Geschmacksstörungen zu den häufigsten Symptomen von COVID-19. Bis zu 70 % der Infizierten leiden unter solchen, bis zum totalen Riechverlust gehenden Störungen. Dies ist auch bei jungen, zuvor gesunden Menschen der Fall, wie die kürzlich erschienene erste Human Challenge Studie zeigte: ein minimales Virus-Inokulum hatte dort ausgereicht, um eine milde Infektion der Atemwege hervorzurufen, allerdings waren zwei Drittel der Infizierten von Riechstörungen bis hin zu Riechverlust betroffen, die zum Teil auch nach 9 Monaten noch andauerten. [7]
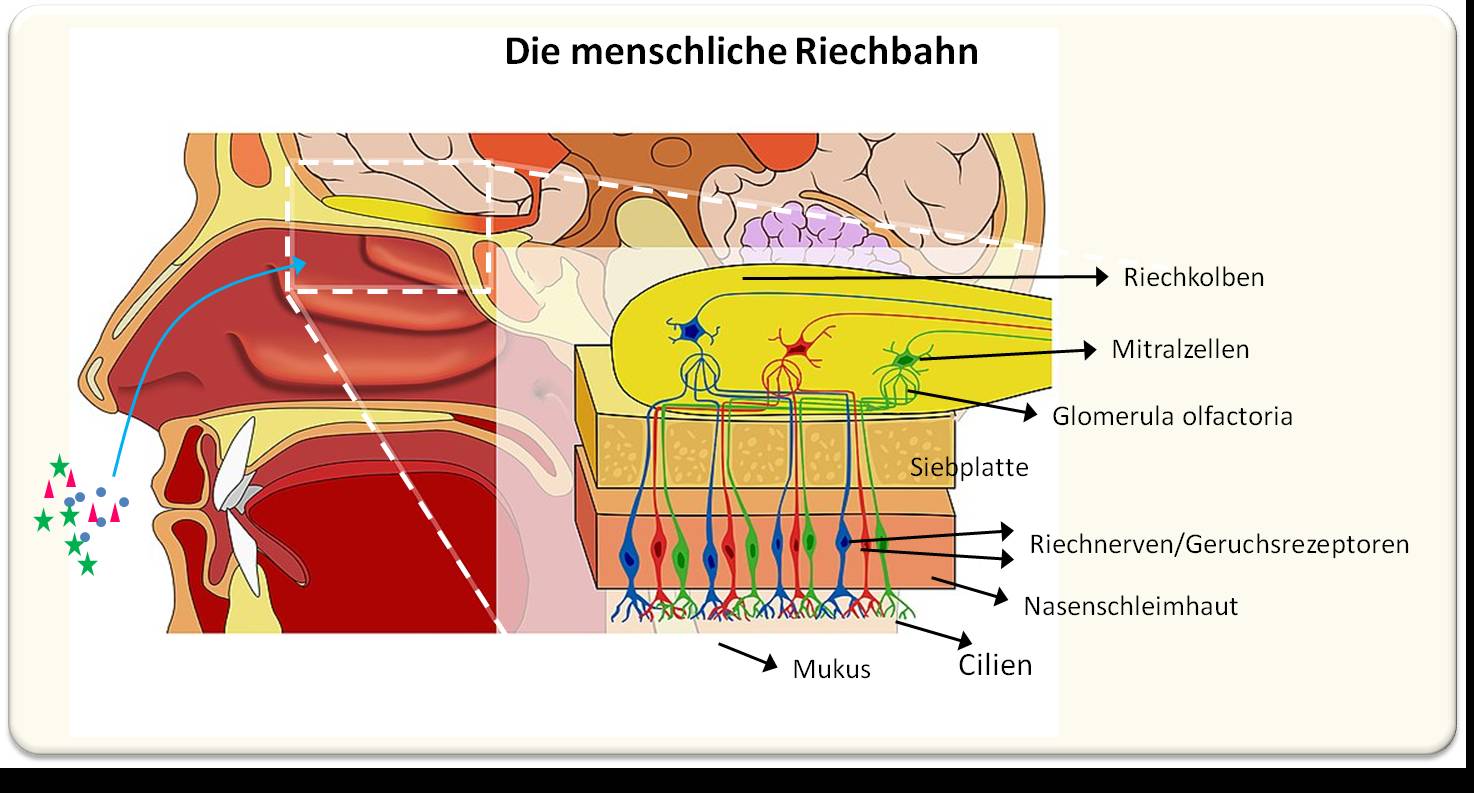
Eine neue, aus verschiedenen US-amerikanischen Institutionen stammende Multicenter-Studie hat nun erstmals ultrastrukturelle Veränderungen des Riechkolbens und des Riechtrakts festgestellt, welche die Schwächung des Riechsystems bis hin zum vollständigen Geruchsverlust erklären können. [3]. Zur Erläuterung: Im Riechkolben, der an der Basis des Gehirns liegt, werden Nervensignale aus der Nasenschleimhaut zusammen mit Informationen über spezifische Gerüche an weiterführenden Neuronen im Gehirn übertragen (Abbildung 1).
| Abbildung 1: Das menschliche Riechsystem (Olfacory System), vereinfachtes Schema. Duftstoffe, die in die Nasenschleimhaut (Regio olfactoria) der oberen Nasenhöhle gelangen, binden an Rezeptoren von bipolaren Riechneuronen, deren zentrales Axon durch die knöcherne Siebplatte hindurch in Form von Riechfäden in den Riechkolben gelangt. Diese von glialen Membranen (Gliazellen) umhüllten, dichten sphäroiden Nervengeflechte (sogenannte Glomeruli olfactorii) sind über Synapsen mit den Mitralzellen verbunden, Neuronen, die über ihre Axone Signale an Hirnareale zur Verarbeitung zu unbewussten und bewussten Geruchswahrnehmungen weiterleiten. (Bild modifiziert aus Andrewmeyerson, https://commons.wikimedia.org/wiki/File:Olfactory_System_Large_Unlabeled.jpg. Lizenz: CC-BY-SA-3.0 |
Um herauszufinden wie die Infektion auf zelluläre Prozesse des Riechens einwirkt, haben die Forscher Gewebe des Riechkolbens und des Riechtrakts von an COVID-19 Verstorbenen und von einer dazu passenden Kohorte an anderen Ursachen Verstorbener ("Kontrollgruppe") isoliert und mit (elektronen)mikroskopischen, histochemischen und molekularbiologischen Methoden analysiert [3]. In den Geweben wurde auf vorhandenes Virus geprüft und Strukturen und Charakteristika der Zellen, der Blutgefäße und die Zahl intakter Axone (welche die Signale der Neuronen weiterleiten) untersucht. Im Vergleich zu den Kontrollen, stellten die Forscher bei den COVID-Patienten schwere pathologische Veränderungen an den Axonen bis hin zum Verlust von Axonen fest und sogenannte Mikrovaskulopathie, d.i. Verletzungen kleinster Blutgefäße. Diese Veränderungen waren besonders ausgeprägt bei Patienten, die über Geruchsbeeinträchtigungen geklagt hatten, standen jedoch in keinem Zusammenhang mit dem Schweregrad der Atemwegserkrankung, dem Zeitverlauf der Infektion oder der Detektierbarkeit von Virus im Riechgewebe. Tatsächlich konnte in den Riechkolben der meisten COVID-19 Patienten kein Virus nachgewiesen werden.
Die Analysen weisen darauf hin, dass nicht das Virus direkt sondern Entzündungsreaktionen als Folge der Infektion zur Schädigung von Nervenzellen und Reduktion bis hin zur Zerstörung ihrer Axone führt. Sinkt die Zahl funktionsfähiger Axone, können Signale nur abgeschwächt bis gar nicht mehr an das Hirn weitergeleitet werden und dies kann - abhängig von der Fähigkeit neue Neuronen zu generieren (Neurogenese) - leider ein permanenter Zustand sein.
Neuropathologische Auswirkungen von SARS-CoV-2 auf nicht-menschliche Primaten
Tiermodelle, welche die neuropathologischen Befunde in Hirngeweben von an COVID-19 verstorbenen Patienten widerspiegeln, können einen essentiellen Beitrag zur Aufklärung der Neuropathogenese dieser Infektion leisten. Tracy Fisher und ihr Team am Tulane National Primate Research Center (Tulane University, New Orleans) haben langjährige Erfahrung mit Modellen unserer nächsten Verwandten, den Makaken (Rhesusaffen und grünen Meerkatzen), insbesondere mit Untersuchungen an deren Gehirnen. (Im übrigen: Makaken werden seit langem als aussagekräftige Modelle genutzt, um einerseits einen Einblick in die Pathogenese von Infektionskrankheiten zu gewinnen und anderseits, um Strategien zur deren Prävention und Behandlung zu testen.) Seit dem Beginn der Corona-Pandemie haben die Forscher zudem die Gehirne von an COVID-19 Verstorbenen untersucht. Die Ergebnisse an den Affen stimmen mit Autopsiestudien von an COVID-19 verstorbenen Menschen überein, die Tiere dürften also geeignete Modelle für die Vorgänge im Menschen darstellen. Untersuchungen von Tracy Fischer haben so zum Verständnis des Infektionsgeschehens beigetragen, insbesondere wie eine Infektion mit dem Virus zu langfristigen Entzündungen und Schäden an zahlreichen Organen führen kann.
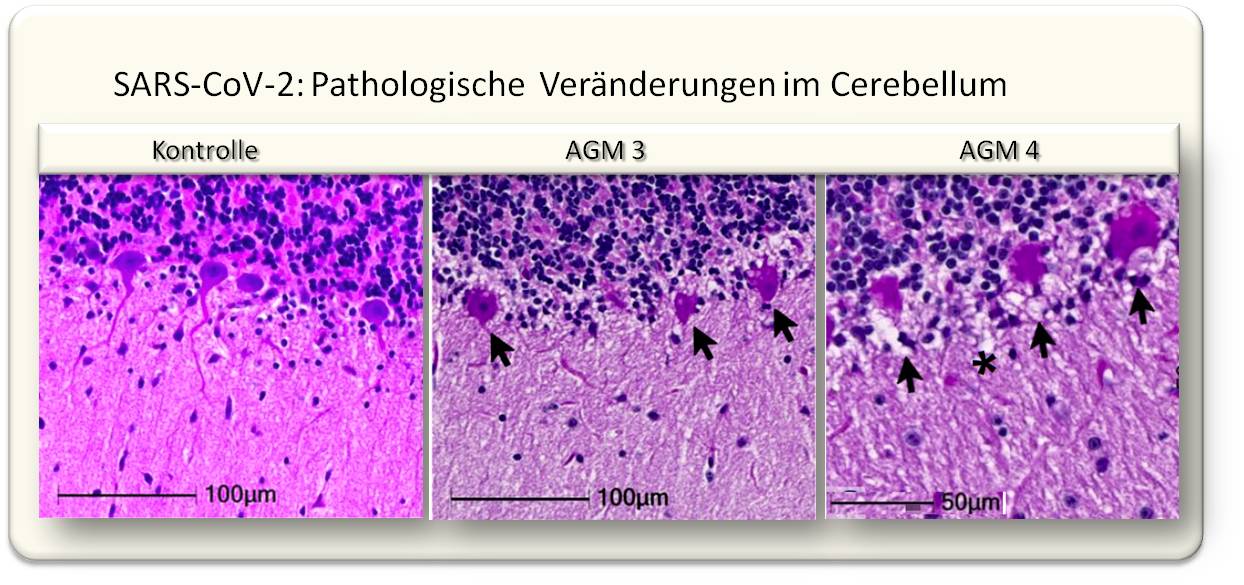
| Abbildung 2: Die Infektion von Makaken mit SARS-CoV-2 führt zwar nicht zu schweren Atemwegserkrankungen, löst aber ausgeprägte morphologische Änderungen bis hin zum Zelltod von Neuronen aus . Dargestellt sind Hämatoxylin/Eosin gefärbte histologische Schnitte des Cerebellums von grünen Meerkatzen (Zellkerne: blau; oben: Körnerschicht). Im Bild links: eine gesunde Schichte von Purkinje-Zellen im Cerebellum eines nicht infizierten Kontrolltiers (RM6), Mitte und rechts: Pfeile weisen auf irreversibel verdichtete (pyknotische) und aufgelöste (karyolytische) Zellkerne und Ausbuchtungen der Zellmembran (cellular blebs) in infizierten Tieren (AGM3 und AGM4). (Bild modifiziert aus [4], Lizenz cc-by]. |
In der aktuellen Studie [4] wird nun gezeigt, dass eine Infektion mit SARS-CoV-2 (WA1/2020) im Gehirn von Makaken zu massiven Entzündungen des Nervengewebes, zu Mikroblutungen und reduzierter Sauerstoffzufuhr (Hirnhypoxie) führt, dass Neuronen degenerieren und absterben. Abbildung 2 zeigt als Beispiel die Schädigung von Purkinje-Zellen (multipolaren Neuronen mit stark verästeltem Dendriten in der Kleinhirnrinde (Cortex cerebelli)). Lecks in Blutgefäßen und durch Sauerstoffmangel hervorgerufene Schädigungen des Gehirngewebes dürften somit eine häufige Komplikation einer SARS-CoV-2-Infektion sein.
Die Tiermodelle erweisen sich dabei als besonders bedeutsam, weil die neuronalen Symptome bei infizierten Tieren beobachtet werden, die keine schweren Atemwegserkrankungen entwickeln: diese Modelle könnten somit einen Einblick in die bis dato "Black Box" von long-Covid erlauben.
SARS-CoV-2 Infektion von Makaken, Gehirnentzündung und Aggregation von alpha-Synuclein
Ein Team aus holländischen/belgischen Wissenschaftern hat ebenfalls Makaken (Rhesus- und Cynomolgus-Makaken) als Modell verwendet, um die neurologischen Auswirkungen einer Infektion mit SARS-CoV-2 (Beta Variante) zu untersuchen [5). Im Zentrum stand die Frage wieweit solche Auswirkungen fünf bis sechs Wochen nach leichten bis mittelschweren Infektionen auftreten können.
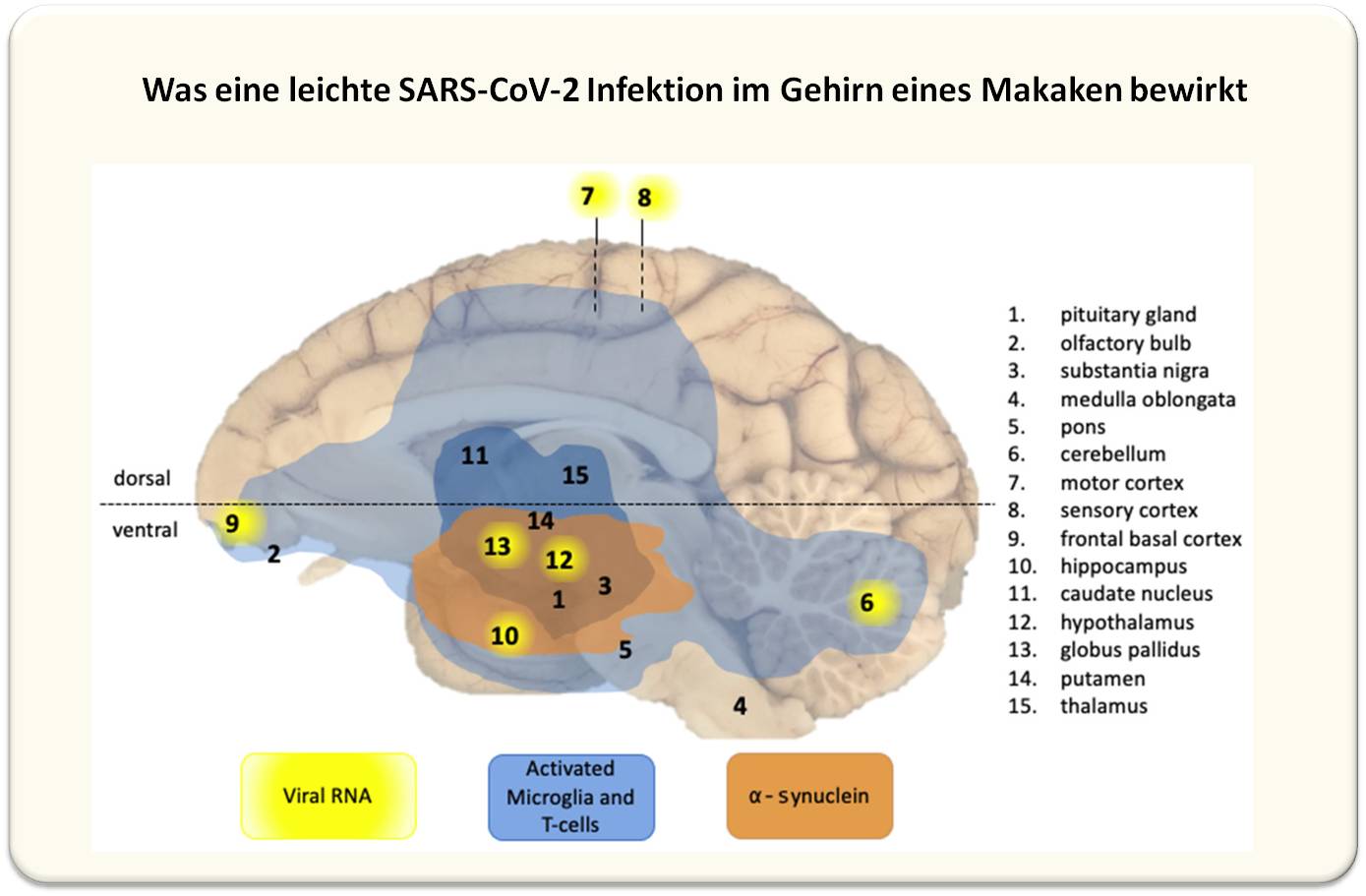
| Abbildung 3: Überblick über die Auswirkungen einer leichten SARS-CoV-2-Infektion auf das Zentralnervensystem von Makaken. 15 Hirnregionen wurden untersucht. Infiltration aktivierter T-Zellen und Mikkrogliazellen wurde in praktisch allen Hirnregionen der infizierten Tiere in geringfügigem Ausmaß (hellblau) und moderatem Ausmaß (dunkelblau) detektiert. alpha-Synuclein Aggregate traten in den orangefarbenen Regionen auf. Virus (gelb) wurde in mehreren Regionen nur in einem Tier (C3) nachgewiesen. (Bild modifiziert aus [5], Lizenz cc-by]. |
Die Studie wurde an post-mortem entnommenen Gewebe aus 15 unterschiedlichen Gehirnregionen ausgeführt. Diese wurden auf Detektierbarkeit von Virus (Antigen und RNA) und Immunreaktion - Infiltration von aktivierten T-Zellen und Mikroglia-Zellen (das sind die primären Immunzellen des Gehirns, entsprechend den peripheren Makrophagen) - untersucht.
Virus wurde nur in einem Makaken (C3) in 7 Gehirnregionen nachgewiesen, Entzündungsreaktionen - Infiltrationen von Immunzellen - traten dagegen in allen infizierten Tieren, nicht aber in Kontrolltieren und mit Ausnahme des Markhirns (medulla oblongata) in allen untersuchten Hirnregionen auf, auch wenn dort weder virales Antigen oder RNA nachweisbar waren. Abbildung 3.
Eine ganz wesentliche neue Erkenntnis war, dass in den Gehirnen aller infizierter Rhesus Affen und eines Cynomolgus Affen, nicht aber in den Kontrollen, Aggregate von alpha-Synuclein entstanden waren [5]. Es sind dies runde Einschlüsse im Zytoplasma von Nervenzellen - sogenannte Lewis bodies -die als Charakteristikum der Parkinson-Erkrankung gelten und für das Absterben von Dopamin-produzierenden Neuronen verantwortlich gemacht werden. Interessanterweise kommt es bei Parkinson häufig zu einem Riechverlust noch bevor sich motorische Defekte zeigen. Ein Überblick über die Auswirkungen einer leichten SARS-CoV-2 Infektion auf das Zentralnervensystem ist in Abbildung 3 gegeben.
Wie kommt es zur alpha-Synuclein Aggregation?
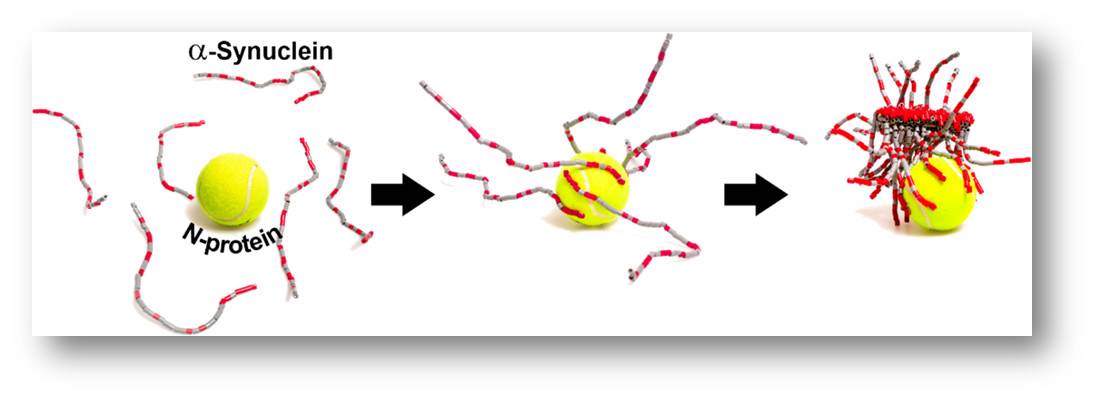
| Abbildung 4: Das Nukleocapsid-Protein (N-Protein) von SARS-CoV-2 interagiert mit mehreren Kopien von alpha-Synuclein und löst deren Aggregation zu zelltoxischen Faserbündeln aus. (Bild aus [7], Lizenz: cc-by-nc-nd) . |
Wie eingangs erwähnt gibt es eine Reihe von Fallstudien, in denen bei relativ jungen Personen einige Wochen nach COVID-19 eine Parkinsonerkrankung ausgebrochen ist. Auf der Suche nach einem möglichen molekularen Zusammenhang zwischen den beiden Erkrankungen haben Forscher entdeckt, dass mehrere Kopien des neuronalen α-Synuclein zumindest in vitro an das Nukleocapsid-Protein (aber nicht an andere Proteine) von SARS-CoV-2 binden und die Bildung von zelltoxischen Aggregaten auslösen [7]. Wurden beide Proteine zusammen in ein Zellmodell von Parkinson injiziert, so führte dies zu einem beschleunigten Absterben der Zelle. Wie man sich diese Aggregation vorstellen kann, ist in Abbildung 4 dargestellt.
Fazit
SARS-CoV-2 Infektionen dürfen nicht auf die leichte Schulter genommen werden!
Nach einem milden Krankheitsverlauf und sogar in asymptomatischen Fällen können neurologische Langzeitfolgen - long-COVID - auftreten und es besteht die Gefahr, dass diese durch erhebliche Schädigungen im Gehirngewebe verursacht werden können. Dies lassen Untersuchungen an nicht-menschlichen Primaten (Makaken) befürchten - aussagekräftigen Modellen, die einen Einblick in die Pathogenese von Infektionskrankheiten erlauben und Möglichkeiten bieten deren Prävention und Behandlung zu testen. Diese mit dem ursprünglichen SARS-CoV-2 Virus oder mit der beta-Variante infizierten Tiere haben zwar nur milde Atemwegserkrankungen entwickelt, wiesen aber in vielen Hirnregionen massive neuropathologische Veränderungen auf, die vergleichbar waren mit den Schädigungen der an COVID-19 verstorbenen Patienten: Entzündungsprozesse in weiten Hirnregionenm die zum Absterben von Nervenzellen führen, Lecks in Blutgefäßen und Blutgerinnsel können eine Erklärung für Langzeitfolgen bis hin zu Schlaganfällen, Hirn(haut)entzündungen und auch beobachteten Parkinson-Fällen bieten.
[1] Inge Schuster, 07.01.2022: Was ist long-Covid?
[2] Francis S.Collins, 15.01.2021: Näher betrachtet: Auswirkungen von COVID-19 auf das Gehirn
[3] Ho C, Salimian M, Hegert J, et al. Postmortem Assessment of Olfactory Tissue Degeneration and Microvasculopathy in Patients With COVID-19. JAMA Neurol. Published online April 11, 2022. doi:10.1001/jamaneurol.2022.0154
[4] Ibolya Rutkai et al., Neuropathology and virus in brain of SARS-CoV-2 infected non-human primates. Nature Commun.(01.04. 2022) https://doi.org/10.1038/s41467-022-29440-z
[5] Ingrid HCHM Philippens et al., Brain Inflammation and Intracellular alpha-Synuclein Aggregates in Macaques after SARS-CoV-2 Infection. Viruses (08.04.2022) 14, 776. https://doi.org/10.3390/v14040776
[6] Slav A. Semerdzhiev et al., Interactions between SARS-CoV-2 N-Protein and α-Synuclein Accelerate Amyloid Formation. ACS Chemical Neuroscience, (03.12.2021); 10.1021/acschemneuro.1c00666
[7] Inge Schuster, 12.02.2022: Wie verläuft eine Corona-Infektion? Ergebnisse der ersten Human-Challenge-Studie
Artikel über COVID-19 im ScienceBlog
Seit Beginn der Pandemie sind dazu bis jetzt 44 Artikel im Blog erschienen.
Die Links zu diesen Artikeln sind in chronologischer Reihenfolge in Themenschwerpunkt Viren gelistet.
- Printer-friendly version
- Log in to post comments