Do, 04.07.2019 - 12:17 — Karin Moelling

![]() Phagen sind Viren, die Bakterien befallen – und das sehr in sehr spezifischer Weise. Bereits ihr Entdecker erkannte vor etwas mehr als 100 Jahren, dass sich bakterielle Infektionen mit Phagen effizient bekämpfen lassen. Mit dem Siegeszug der Antibiotika gerieten Phagen aber in den meisten Ländern in Vergessenheit. Die Entstehung von Antibiotika-resistenten Bakterien und der Mangel an neuen Substanzen, die gegen solche Keime wirken, hat das Interesse an einer Phagentherapie heute wieder aufleben lassen. Die renommierte Virologin Karin Mölling (em. Prof. für Virologie der Universität Zürich und Gruppenleiterin am Max-Planck-Institut für molekulare Genetik) erklärt hier was Phagen sind und wie sie funktionieren. In einem nachfolgenden Teil werden dann viel versprechende Beispiele der Phagentherapie geschildert.
Phagen sind Viren, die Bakterien befallen – und das sehr in sehr spezifischer Weise. Bereits ihr Entdecker erkannte vor etwas mehr als 100 Jahren, dass sich bakterielle Infektionen mit Phagen effizient bekämpfen lassen. Mit dem Siegeszug der Antibiotika gerieten Phagen aber in den meisten Ländern in Vergessenheit. Die Entstehung von Antibiotika-resistenten Bakterien und der Mangel an neuen Substanzen, die gegen solche Keime wirken, hat das Interesse an einer Phagentherapie heute wieder aufleben lassen. Die renommierte Virologin Karin Mölling (em. Prof. für Virologie der Universität Zürich und Gruppenleiterin am Max-Planck-Institut für molekulare Genetik) erklärt hier was Phagen sind und wie sie funktionieren. In einem nachfolgenden Teil werden dann viel versprechende Beispiele der Phagentherapie geschildert.
Viren - so viele wie Sterne am Himmel…
Die meisten Menschen denken bei Viren an Erreger von Krankheiten, denn in diesem Zusammenhang wurden Viren gegen Ende des 19. Jahrhunderts zuerst gefunden. In Anbetracht der unvorstellbar großen Anzahl an Viren - Schätzungen gehen von insgesamt 1033 (1 Trillion Billiarden) Viren auf der Erde aus - ist die durch Viren verursachte Todesrate jedoch vergleichsweise gering.
Viren sind überall - in den Meeren, in der Umwelt, in Tieren, Pflanzen und auch auf und in uns. Die kleinsten Viren sind hundertfach kleiner als Bakterien, die größten sogenannten Gigaviren, die Forscher kürzlich nach 30000 Jahren im ewigen Frost wieder zum Leben erweckt haben, sind größer als viele Bakterien.
Genauso wie Bakterien, besiedeln auch Viren in hoher Anzahl unseren Körper. Im Innern eines gesunden Menschen koexistieren mehrere Billionen Bakterien und etwa 100 mal mehr Viren; ein ausgewogenes Gleichgewicht von Viren zu Bakterien ist notwendig für die Gesundheit und für die Verdauung.
…und ihre Spuren in unserem Erbgut
Dank der modernen Genomforschung war es Anfang dieses Jahrhunderts gelungen, das menschliche Erbgut komplett zu sequenzieren. Seitdem wurden Tausende Humangenome und ebenso das Erbgut vieler anderer Organismen detailliert - Buchstabe für Buchstabe - bestimmt. Vergleiche dieser immensen Datenmengen führten zu der sensationellen Entdeckung, dass unsere DNA zahllose »fremde« Gene aufweist: Sequenzen, die ursprünglich von diversen, völlig anderen Organismen stammen, die in der Evolution dann Bestandteile unserer eigenen genetischen Ausstattung geworden sind und nun von Generation zu Generation weitergegeben werden. Fast die Hälfte dieser Sequenzen stammt von Viren.
Neue Untersuchungen weisen darauf hin, dass die zellulären Immunsysteme von der Integration solcher Sequenzen herrühren, also eingebaute Viren die Zelle vor weiteren Virusinfektionen schützen und sich von einfachen adaptiven Systemen zu hochkomplexen Abwehrstrategien entwickelt haben.
"Unsichtbare Mikroben, die Bakterien fressen"
Bakteriophagen, kurz Phagen genannt, sind Viren, die spezifisch Bakterien befallen. Vor etwas mehr als hundert Jahren entdeckte der Frankokanadier Félix d’Hérelle (1873–1949) am Institut Pasteur "unsichtbare Mikroben", die Bakterien zerstörten - Löcher in gezüchtete Rasen von Ruhr-erzeugenden Bakterien fraßen. D'Herelle benannte sie Bakteriophagen (phagein ist das griechische Wort für fressen) und erkannte sofort das Potential seiner Entdeckung: die therapeutische Anwendung dieser Bakteriophagen bei bakteriellen Infektionen (Abbildung 1).
 Abbildung 1.Links: Bereits 1917 berichtet Felix d'Herelle über "eine unsichtbare Mikrobe, die gegen Ruhrbakterien wirksam ist" (Comptes rendus hebdomadaires des séances de l‘Académie des Sciences 165, S. 373–375, 1917). Rechts: Phagen zerstören Bakterien (Beispiel: Gammaphagen haben einen kreisrunden Lysehof in einen Rasen von Bacillus anthracis "gefressen". Bild: Wikipedia, gemeinfrei).
Abbildung 1.Links: Bereits 1917 berichtet Felix d'Herelle über "eine unsichtbare Mikrobe, die gegen Ruhrbakterien wirksam ist" (Comptes rendus hebdomadaires des séances de l‘Académie des Sciences 165, S. 373–375, 1917). Rechts: Phagen zerstören Bakterien (Beispiel: Gammaphagen haben einen kreisrunden Lysehof in einen Rasen von Bacillus anthracis "gefressen". Bild: Wikipedia, gemeinfrei).
D'Herelle hat die Phagen aus infizierten Proben gewonnen, indem er sie durch ein Keramiksieb von den Bakterien abtrennte und hat sie dann in verschiedenen Ländern bei bakteriellen Epidemien therapeutisch erprobt, etwa gegen Cholera in Indien. Damit erzielte er zum Teil sensationelle Erfolge: Todkranke, die abends einen speziellen Phagentrunk erhielten, waren am nächsten Morgen geheilt!
Diese Art der Therapie funktionierte aber manchmal auch schlechter. Offensichtlich kam es darauf an für die jeweils zu behandelnde Infektion die passenden Phagen einzusetzen (Phagen sind ja hoch spezialisiert und docken nur an ganz bestimmte Bakterien an). Da d'Herelle dachte, dass sein Wundertrank möglicherweise keine passenden Phagen enthalte, kam er auf die Idee den Kranken ein Gemisch aus verschiedenen Phagenstämmen - einen "Phagencocktail" - zu verabreichen. Auch diese Therapie funktionierte leider nicht immer und überall.
Jedenfalls waren damalige Kollegen und Kontrahenten in den westlichen Ländern von der Phagentherapie nicht überzeugbar - offensichtlich verwendeten sie immer Phagen, die nicht passten. Als dann Antibiotika während und nach dem Zweiten Weltkrieg ihren Siegeszug antraten, geriet die Phagentherapie in Vergessenheit.
Nur dort, wo Antibiotika lange nicht verfügbar waren -in Ländern hinter dem Eisernen Vorhang - wurde Forschung an Phagen und Phagentherapie weiter betrieben.
Phagen wurden entdeckt, vergessen und wiederentdeckt. Bis in die späten 1960er Jahre dienten Phagen (insbesondere vom Typ der T4-Phagen und Lamda-Phagen) als Modelle, um grundlegende Prinzipien der modernen Molekularbiologie zur Organisation und Regulation von Genen zu erforschen.
Wie sehen Phagen aus?
Als Prototyp für Phagen gilt der T4-Phage, der spezifisch Darmbakterien des Typs Escherichia-coli befällt. Abbildung 2.
 Abbildung 2. Phagen im Elektronenmikroskop. A) T4-ähnliche Phagen, die durch das Nachweisverfahren die Beine verloren haben, am Schwanzende tritt etwas DNA aus. B) Ein einzelner T-4 Phage misst vom Kopf bis zu den Filamenten rund 100 Nanometer. C) Schematische Darstellung des Aufbaus eines T4-Phagen (Bilder: A), B): Karin Moelling; C): modifiziert nach Guido4, Wikipedia, Lizenz cc-by-sa)
Abbildung 2. Phagen im Elektronenmikroskop. A) T4-ähnliche Phagen, die durch das Nachweisverfahren die Beine verloren haben, am Schwanzende tritt etwas DNA aus. B) Ein einzelner T-4 Phage misst vom Kopf bis zu den Filamenten rund 100 Nanometer. C) Schematische Darstellung des Aufbaus eines T4-Phagen (Bilder: A), B): Karin Moelling; C): modifiziert nach Guido4, Wikipedia, Lizenz cc-by-sa)
Im Elektronenmikroskop sind die Komponenten erkennbar: Der ikosaedrische Kopf, Kapsid genannt, enthält das Erbgut - bei Phagen zumeist DNA -, welches der Phage durch das Rohr im kontraktilen »Schwanz« in ein Bakterium injiziert. Mit den angeknickten Beinchen, den Filamenten , verankert sich der Phage an der Wirtszelle. Die Wechselwirkung dieser Beine mit der Zelle ist höchst selektiv: Jeder Phage muss seine eignen Wirtszelle finden und nimmt keine andere. Abbildung 3.
Das war und ist eine der großen Schwierigkeiten in der therapeutischen Anwendung von Phagen: während Antibiotika auch eine Bandbreite von Bakterien ohne passgenaue Abstimmung abtöten, müssen Phagen spezifisch an die Keime jedes einzelnen Patienten angepasst werden.
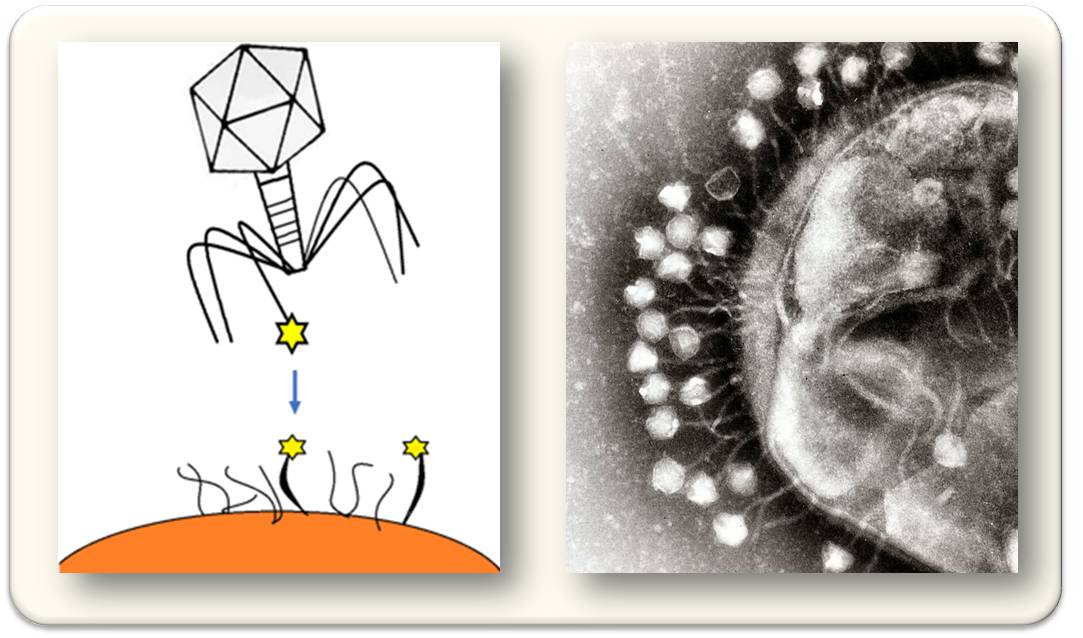 Abbildung 3. Phagen erkennen mit ihren Beinchen Rezeptoren auf der Oberfläche der Wirtszelle und binden an diese hochspezifisch und irreversibel. Links: Schematische Darstellung (Quelle: wikimedia, CarlosRoBe, Lizenz CC BY-SA 4.0). Rechts: Elektronenmikroskopische Aufnahme von T1-Phagen, die sich auf der Zellwand von E. coli festgesetzt haben. (Quelle: Dr Graham Beards- en:Image:Phage.jpg. cc-by-sa 3.0; Wikipedia)
Abbildung 3. Phagen erkennen mit ihren Beinchen Rezeptoren auf der Oberfläche der Wirtszelle und binden an diese hochspezifisch und irreversibel. Links: Schematische Darstellung (Quelle: wikimedia, CarlosRoBe, Lizenz CC BY-SA 4.0). Rechts: Elektronenmikroskopische Aufnahme von T1-Phagen, die sich auf der Zellwand von E. coli festgesetzt haben. (Quelle: Dr Graham Beards- en:Image:Phage.jpg. cc-by-sa 3.0; Wikipedia)
Wie funktionieren Phagen?
Phagen vermehren sich auf Kosten ihrer Wirtszellen, der Bakterien. Nachdem Phagen ihre DNA in die jeweilige Wirtszelle injiziert haben, können zwei unterschiedliche Arten der Vermehrung eingeschlagen werden, die mit "Lytischer Zyklus" und "Lysogener Zyklus" bezeichnet werden. Abbildung 4.
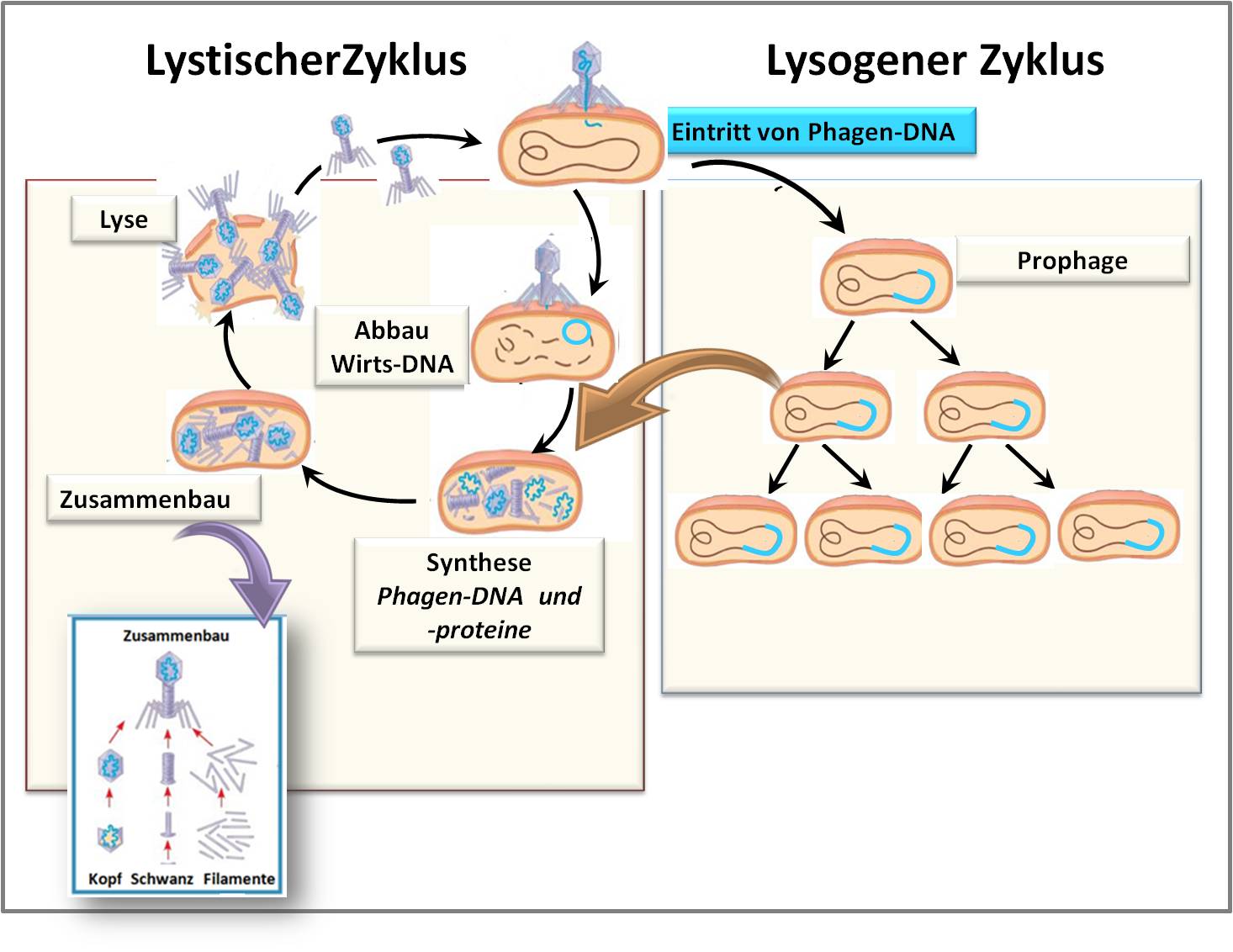 Abbildung 4. Wie Phagen mit Bakterien interagieren: Im Lytischen Zyklus tritt sofort Vermehrung ein, bringt die Wirtszelle zum Platzen und die neuen Phagen infizieren weitere Zellen. Im Lysogenen Zyklus wird die Phagen-DNA (blau) in das Bakterien-Chromosom (braun) integriert und über Generationen vererbt. Unter Stress kann aber auch der Übergang der integrierten Prophagen in den Lytischen Zyklus eintreten (brauner Pfeil). (Bild: modifiziert nach xxoverflowed; wikimedia. cc-by-2.0 https://www.flickr.com/photos/hixtine/6374709127)
Abbildung 4. Wie Phagen mit Bakterien interagieren: Im Lytischen Zyklus tritt sofort Vermehrung ein, bringt die Wirtszelle zum Platzen und die neuen Phagen infizieren weitere Zellen. Im Lysogenen Zyklus wird die Phagen-DNA (blau) in das Bakterien-Chromosom (braun) integriert und über Generationen vererbt. Unter Stress kann aber auch der Übergang der integrierten Prophagen in den Lytischen Zyklus eintreten (brauner Pfeil). (Bild: modifiziert nach xxoverflowed; wikimedia. cc-by-2.0 https://www.flickr.com/photos/hixtine/6374709127)
Im Lytischen Zyklus bleibt die injizierte Phagen-DNA separiert vom bakteriellen Erbgut, wird auf Kosten des bakteriellen Stoffwechsels rasant vermehrt und führt zur Produktion von Phagen-Bauteilen. Die Bauteile setzen sich zu Hunderten neuen Phagen zusammen und bringen schlussendlich die Wirtszelle zum Platzen - lysieren diese -, schwirren aus und infizieren weitere Bakterien.
Im Lysogenen Zyklus wird die Phagen-DNA vorerst in das Erbgut des Bakteriums - als Prophage -integriert und kann dann über viele Generationen weitervererbt werden. Gerät das Bakterium in eine Stresssituation - etwa bei zu hoher Keimdichte, Nahrungsmangel, Temperaturstress, etc. - kann ein Wechsel zum lytischen Zyklus erfolgen (brauner Pfeil in Abb. 4) und die Vermehrung der Phagen gestartet werden.
(Auf ähnliche Weise gelangen Viren in das Erbgut vieler Lebewesen; sie sind darin latent werden weitervererbt, wenn sich die Zellen teilen und können manchmal bei Stress virulent werden.)
Die Phasen von Synthese und Zusammenbau von Phagen können elektronenmikroskopisch verfolgt werden. Abbildung 5.
 Abbildung 5. SU 10-Phagen, die in E. coli Zellen gebildet werden im Elektronenmikroskop. An der Oberfläche der Zellwand haften noch leere Kapside (rote Pfeile), die ihre DNA bereits injiziert haben. Im Cytoplasma des Bakteriums bilden die neuen Phagen Honigwaben ähnliche Strukturen (blaue Pfeile); in vielen Kapsiden ist die DNA bereits eingefügt (dunkle Kapside). (Bild: SU10progj.jpg; wikimedia. nach KM Mirzaei et al., http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0116294 . CC BY 4.0 .)
Abbildung 5. SU 10-Phagen, die in E. coli Zellen gebildet werden im Elektronenmikroskop. An der Oberfläche der Zellwand haften noch leere Kapside (rote Pfeile), die ihre DNA bereits injiziert haben. Im Cytoplasma des Bakteriums bilden die neuen Phagen Honigwaben ähnliche Strukturen (blaue Pfeile); in vielen Kapsiden ist die DNA bereits eingefügt (dunkle Kapside). (Bild: SU10progj.jpg; wikimedia. nach KM Mirzaei et al., http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0116294 . CC BY 4.0 .)
Wie Dichtestress die in den Bakterien vorhandenen Phagen aktiviert, kann am Beispiel der durch Cyanobakterien verursachten Algenblüte in Gewässern verdeutlicht werden. In längeren warmen Phasen vermehren sich die Bakterien infolge von Überdüngung oftmals stark, dann stoppt der Vorgang aber plötzlich. Der Grund dafür: Im Meereswasser sind etwa 80 Prozent der Bakterien von ihren Phagen infiziert, die durch Dichtestress aktiviert werden, sich rasant vermehren und ihre Wirtsbakterien weitgehend zerstören. Normalerweise sind Bakterien und Phagen so aufeinander eingespielt, dass Phagen täglich etwa ein Drittel der vorhandenen Bakterien auflösen, wodurch deren Bestandteile wieder in die Nahrungskette gelangen.
Eine Besonderheit der Phagen Ist, dass sie sich nur solange in den Bakterien vermehren, wie es diese Bakterien gibt. Wenn sie alle Bakterien getötet haben, können sich die Phagen nicht mehr vermehren und gehen auch zugrunde. Je mehr Bakterien vorhanden sind , umso mehr Phagen werden produziert. Dies bedeutet, dass für eine therapeutische Anwendung von Phagen eine Dosis- Wirkung Korrelation besteht und dass eine solche Therapie selbst limitierend ist, aber auch ein Minimum an Bakterien zu Beginn der Therapie erfordert.
Wie und gegen welche Infektionen die Phagen eingesetzt werden können und welche Erfolge bis jetzt erzielt wurden, soll in einem nachfolgenden Artikel behandelt werden.
Weiterführende Links
Karin Moelling: Welt der Viren, 2. Phagen (2015); Video 9:22 min. https://www.youtube.com/watch?v=65aD8lvOpRY
Karin Moelling: Ohne Viren gäbe es schlicht kein Leben. Virologin Prof. Dr. Karin Mölling zu Gast bei KKL Impuls (2016), Video 1:17:05 min. https://www.youtube.com/watch?v=3ThS_Rsr5B8
Karin Moelling: Collect Phages to Kill resistant Bacteria (deutsch). 2019; Video 12:14 min. https://www.youtube.com/watch?v=RfC5PUSscok
Sternstunde Philosophie: Durchbruch in der Aids-Forschung. Die Virologin Karin Mölling im Gespräch mit Norbert Bischofberger. (2008) Video 56:35 min. https://www.srf.ch/play/tv/sternstunde-philosophie/video/sternstunde-philosophie-durchbruch-in-der-aids-forschung--die-virologin-karin-moelling-im-gespraech-mit-norbert-bischofberger?id=37c4497c-ed6c-4b96-815d-4400a6b36442
T4 Phage früher Bakteriophage T4. 2016; Video 8:05 min. https://www.youtube.com/watch?v=VX-unNBw-KM
Udo Pollmer: Bakteriophagen - natürlicher Ersatz für Antibiotika und Desinfektion? 2013; Video 7:38 min. https://www.youtube.com/watch?v=YmnWWVxLvVU
Einige Artikel über Viren im ScienceBlog
Gottfried Schatz, 03.05.2013: Spurensuche — Wie der Kampf gegen Viren unser Erbgut formte
Peter Palese, 10.5.2013: Influenza-Viren – Pandemien: sind universell wirksame Impfstoffe in Reichweite?
Peter Schuster, 24.5.2013: Letale Mutagenese — Strategie im Kampf gegen Viren
Gottfried Schatz, 5.12.2014: Gefahr aus dem Dschungel – Unser Kampf gegen das Ebola-Virus
Richard Neher, 3.11.2016: Ist Evolution vorhersehbar? Zu Prognosen für die optimale Zusammensetzung von Impfstoffen
Guy Reeves, 09.05.2019: Zur Freisetzung genetisch veränderter Organismen in die Natur
- Printer-friendly version
- Log in to post comments
