Do, 04.04.2024 — Inge Schuster
![]()
Obwohl Fluor zu den am häufigsten vorkommenden Elementen der Erdkruste zählt, hat die belebte Natur von der Schaffung fluorierter organischer Verbindungen abgesehen, da sie offensichtlich mit den über die Evolution entwickelten und erprobten Kohlenstoff-Wasserstoff-Systemen inkompatibel sind. Vor 70 Jahren haben synthetisch hergestellte fluororganische Verbindungen, insbesondere per- und polyfluorierte Alkylverbindungen (PFAS) ihren Siegeszug durch die Welt angetreten. Deren herausragende Eigenschaften - Widerstandsfähigkeit gegenüber chemischen Verbindungen aller Art, Hitze und Wasser - haben sich leider auch als enorm hohe Persistenz gegenüber natürlich entstandenen Abbaumechanismen erwiesen. Dass PFAS in Umwelt und Organismen akkumulieren, war den führenden Industrieunternehmen schon länger bekannt, im Bewusstsein der akademischen Welt und der Bevölkerung samt ihren zögerlich agierenden Vertretern ist das Problem erst im Jahr 2000 angekommen.
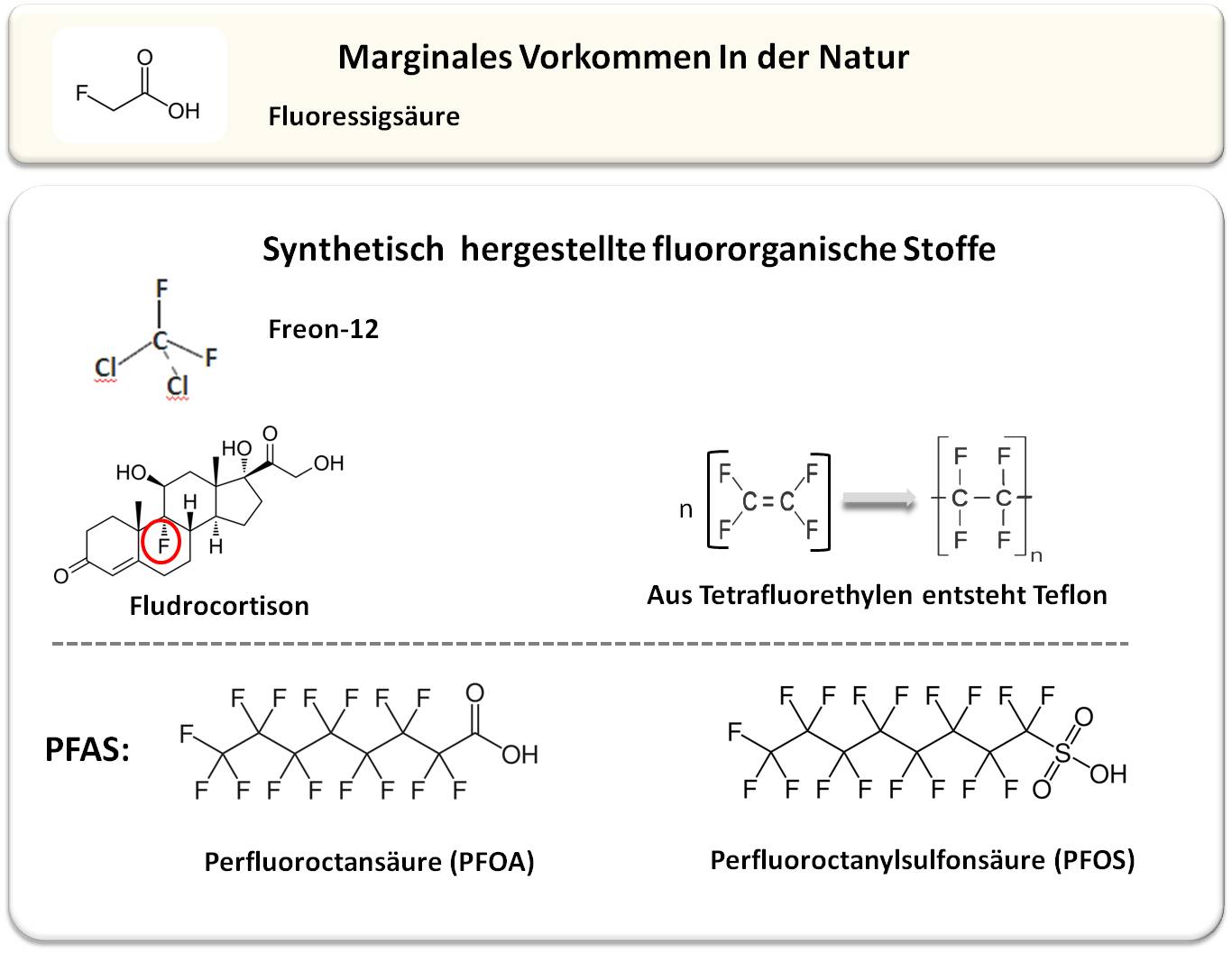
Fluor, das leichteste Element aus der Grupe der Halogene (7. Hauptgruppe im Periodensystem, die auch Chlor, Brom und Jod enthält) ist extrem reaktiv und bildet mit nahezu allen Elementen des Periodensystems enorm feste Verbindungen. In der Erdkruste gehört Fluor zu den am häufigsten vorkommenden Elementen und liegt hier in Form von anorganischen Verbindungen - in Mineralien wie u.a. Flussspat, Fluorapatit und Kryolith - vor. Von minimalen Ausnahmen abgesehen hat die belebte Natur allerdings für Fluor keine Verwendung gefunden: Seitdem vor rund 80 Jahren die erste natürlich entstandene Fluorkohlenstoff-Verbindung, die Fluoressigsäure (CH2FCO2H, Abbildung 1), entdeckt wurde, hat man trotz immer besser werdender Analysemethoden und einer immer größeren Fülle an untersuchbarer Spezies erst um die 30 natürlich entstandene Fluorkohlenstoff-(fluororganische)-Verbindungen gefunden, zumeist von der Fluoressigsäure abgeleitete Fluor-Fettsäuren und Fluoraminosäuren. Deren Vorkommen ist auf einige wenige Pflanzenarten, Bakterienstämme (Streptomyces) und eine Meeresschwammart beschränkt. Die bereits erwähnte Fluoressigsäure wird u.a. vom südafrikanischen Strauch Gifblaar synthetisiert und - offensichtlich zur Abwehr von Fressfeinden - in dessen Blättern gespeichert: es ist eine hochgiftige Verbindung, es heißt: "ein Blatt reicht um eine Kuh zu töten". Die Toxizität beruht auf der strukturellen Ähnlichkeit mit der Essigsäure, die eine zentrale Rolle im Stoffwechsel aller aerober Organismen spielt: Fluoressigsäure wird an deren Stelle in den Citratzyklus eingeschleust und bringt diesen zum Erliegen.
|
Abbildung 1: Fluororganische Verbindungen werden nahezu ausschließlich synthetisch durch Menschenhand hergestellt. Beschreibung der abgebildeten Substanzen im Text. |
Die Natur verzichtet auf fluororganische Verbindungen
Die Bindung von Fluor an Kohlenstoff ist die stärkste Einfachbindung in der organischen Chemie, bei weitem stärker als dessen Bindung zu den anderen Elementen Wasserstoff, Sauerstoff, Stickstoff, Schwefel und Phosphor und sie nimmt an Stärke noch zu, wenn mehrere Fluoratome am selben Kohlenstoff gebunden sind, wie beispielsweise im Tetrafluorkohlenstoff (CF4) mit einer Dissoziationsenergie von 130 kcal/mol oder in den künstlich hergestellten Per- und Polyfluoralkyl Stoffen.
Wird in einer Kohlenstoff-Wasserstoffbindung der Wasserstoff durch ein Fluoratom ersetzt, so ändert sich die Größe des gesamten Moleküls nur wenig, da der Atomradius von Fluor nicht viel größer als der von Wasserstoff ist. Das modifizierte Molekül wird meistens noch in die Bindungsstelle seines vormaligen Enzyms, seines vormaligen Rezeptors passen; allerdings haben sich seine Gesamteigenschaften verändert und damit die Spezifität und Stärke der Bindung und damit die Auswirkungen auf den vormaligen Rezeptor/das Enzym und dessen Funktion im Stoffwechsel verändert: i) Der Ersatz von Wasserstoff kann aber zu einer anderen Stereochemie des Moleküls geführt haben, wenn ein asymmetrisches (im Spiegelbild nicht deckungsgleiches - chirales) C-Atom entstanden ist. ii) Da Fluor das elektronegativste, d.i. das am stärksten Elektronen anziehende Element ist, weist die Kohlenstoff-Fluorbindung ein Dipolmoment (δ+C–δ−F) mit negativer Teilladung am Fluor auf. Fluor kann so mit (partiell) positiv geladenen Atomen wie dem an Sauerstoff oder Stickstoff gebundenen Wasserstoff Bindungen - Wasserstoffbrücken - ausbilden. (Auswirkungen eines teilweisen Einbaus von Fluor auf die Basenpaarungen der DNA oder auf die Wechselwirkungen zwischen Proteinen? Undenkbar) iii) Mit der Einführung von Fluor hat die Lipophilie der Verbindung und damit die Löslichkeit in und der Durchtritt durch Membranen zugenommen. iv) Wenn es vor allem um den Abbau/das Recyceln der fluorierten Verbindung geht - die Kohlenstoff-Fluor-Bindung lässt sich durch bereits entwickelte Enzymsysteme nicht so leicht wie eine Kohlenstoff- Wasserstoff-Bindung auflösen.
In Summe: fluorierte organische Verbindungen erweisen sich als nur wenig kompatibel mit den über die Evolution entwickelten und erprobten Kohlenstoff-Wasserstoff-Systemen.
Fluororganische Verbindungen sind also anthropogen
Die Produktion derartiger Stoffe begann vor 90 Jahren mit dem Halogenkohlenwasserstoff Freon-12 (Dichlordifluormethan - CCl2F2; Abbildung 1), einem ungiftigen, verflüssigbaren Gas, das als Kältemittel in Kühlsystemen und später auch als Treibgas in Sprühdosen eingesetzt wurde. Als erkannt wurde, dass Freon und weitere Halogenkohlenwasserstoffe auf die schützende Ozonschicht der Erde zerstörend wirken, wurde deren Herstellung und Verwendung ab 1987 über das Montreal Protokoll verboten.
Zwei Entwicklungen haben dann einen ungeahnten Boom an synthetisch produzierten Fluorverbindungen ausgelöst.
In der medizinischen Chemie
wurde 1954 mit dem Aldosteronderivat Fludrocortison (Abbildung 1) erstmals ein fluoriertes Pharmazeutikum erfolgreich auf den Markt gebracht, das von der WHO in die Liste der essentiellen Arzneimittel aufgenommen wurde. Die gezielte Einführung von Fluor gehörte bald zu den aussichtsreichsten Strategien der medizinischen Chemie, um die Wirkdauer und insgesamt die Wirksamkeit von Entwicklungssubstanzen zu optimieren. Zwei Fluor-Effekte sind dabei von besonderer Bedeutung: i) Fluorierung an Schwachstellen, d.i. an leicht metabolisierbaren Stellen eines Moleküls soll diese Reaktionen erschweren/verhindern und damit die biologische Stabilität der Verbindung und dadurch deren Blutspiegel und Wirkdauer erhöhen. ii) Fluorierung erhöht den lipophilen Charakter von Molekülen und soll so deren Durchtritt durch Lipidmembranen und damit deren Aufnahme in den Organismus und in seine Zellen erleichtern.
In den letzten 3 Jahrzehnten hat der Anteil der fluorierten Wirkstoffe besonders stark zugenommen - bis zu 50 % der neu registrierten synthetischen Pharmaka enthalten heute ein oder mehrere Fluorgruppen und insgesamt über 20 % aller derzeit im Handel erhältlichen Arzneimittel sind bereits Fluorpharmazeutika.
Neue Untersuchungen weisen allerdings auch auf eine Kehrseite der Fluorierung hin: In chemisch instabilen Molekülen und im Verlauf von enzymatischen Reaktionen kann auch die sehr feste Kohlenstof-Fluor-Bindung heterolytisch gespalten werden (d.i. die Bindungselektronen bleiben am Fluor) und Fluorid (F-) wird freigesetzt [Yue Pan, 2019]. Diese Freisetzung lässt sich sehr gut an verschiedenen, mit dem 18Fluor-Isotop markierten Verbindungen verfolgen, die zur Diagnose und auch zur Therapie diverser Tumoren in der Positron-Emissionstomographie (PET) eingesetzt werden (beispielsweise: [Ying-Cheng Huang et al.2016]).
Chronisch anhaltende Fluorid-Zufuhr von täglich mehr als 10 mg Fluorid kann zu schmerzhaften Veränderungen in Knochen und Gelenken (Skelettfluorose) führen. Ein klinisch belegtes Beispiel für die Freisetzung von Fluorid und dessen Folgen bietet das Antimykotikum Voriconazol, das bei Langzeittherapie zu erhöhten Fluoridspiegeln im Plasma und als Folge zu schmerzhaften Beinhautentzündungen und Knochenwucherungen führen kann.
In industriellen Anwendungen
hat die Entdeckung von Teflon (Polytetrafluorethylen, Abbildung 1) und seinen herausragenden Eigenschaften seit den 1950er Jahren zur Entwicklung von mehr als 10 000 unterschiedlichen Stoffen aus der Kategorie der per- und polyfluorierten Alkylverbindungen (PFAS) geführt; dies sind Verbindungen an denen die Wasserstoffatome an den Kohlenstoffatomen ganz oder teilweise durch Fluoratome ersetzt sind (Abbildung 1). Aufgrund der Chemikalienbeständigkeit und wasser-, hitze-, und schmutzabweisenden Eigenschaften wurden und werden PFAS in diversesten Artikeln eingesetzt. Das Spektrum reicht von Feuerlöschschaum bis hin zu wasserdichter Bekleidung, von schmutzabweisenden Beschichtungen bis zu antihaftbeschichtetem Kochgeschirr, von Dichtungsmaterial bis hin zu in Chemielabors und in der Medizintechnik verwendeten inerten Materialien. Zwei der in verschiedenen Anwendungen am häufigsten verwendeten PFAS-Verbindungen sind Perfluoroctansäure (PFOA) und Perfluoroctansulfonsäure (PFOS) (Abbildung 1). Diese langkettigen Stoffe entstehen durch Umweltprozesse auch aus anderen instabileren PFAS.
Die Widerstandsfähigkeit dieser ungemein nützlichen Stoffe ist leider auch die Basis ihrer negativen Auswirkungen auf Mensch und Umwelt: Geschützt durch die dichte Hülle aus Fluoratomen ist das Kohlenstoffskelett praktisch nicht abbaubar; die "Ewigkeitschemikalien" akkumulieren in Boden und Grundwasser und gelangen über Wasser und Nahrungsketten in Mensch und Tier.
|
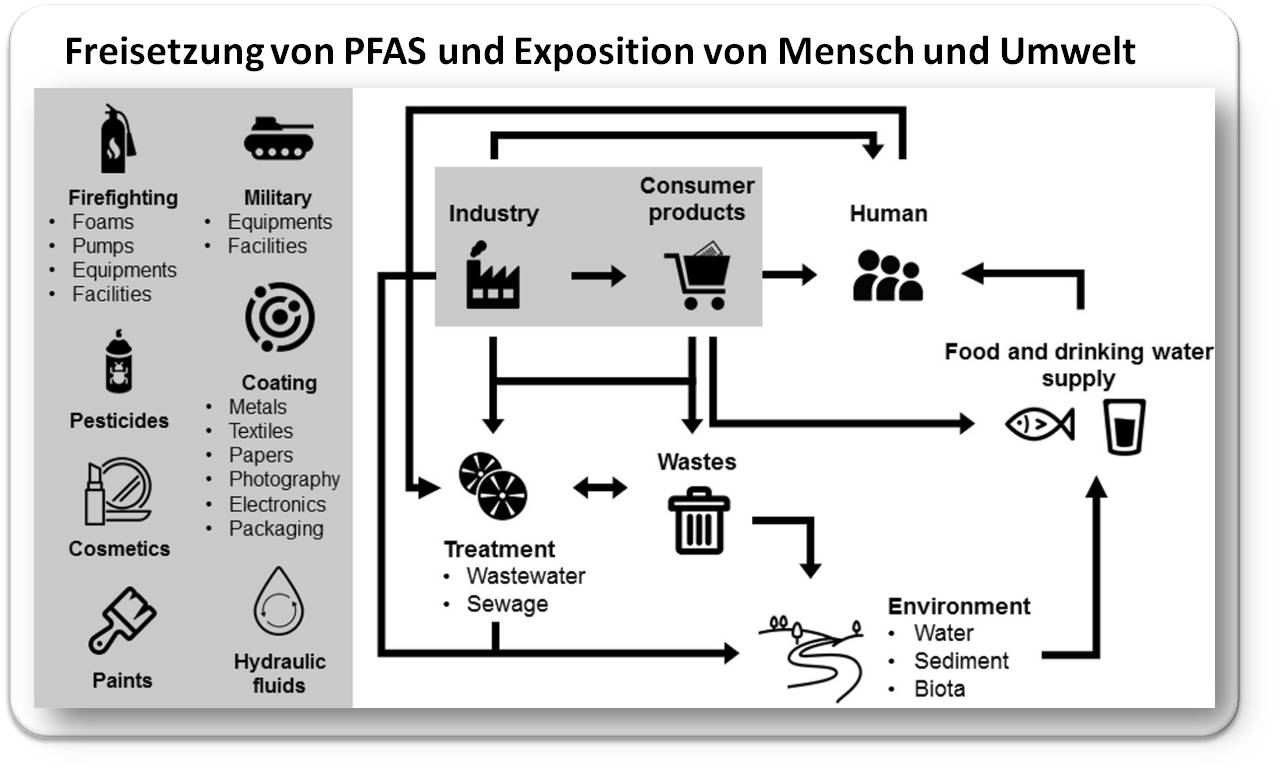
Abbildung 2: Die weit verbreitete Verwendung von PFAS hat dazu geführt, dass diese in der Umwelt nun allgegenwärtig sind. Das Vorhandensein von PFAS im Ökosystem bedeutet, dass sie in verschiedene terrestrische und aquatische Nahrungsketten und -netze gelangen und schließlich den Menschen als Endverbraucher erreichen (Quelle: Figure 3 in Wee, S.Y., Aris, A.Z. (2023). https://doi.org/10.1038/s41545-023-00274-6.. Lizenz: cc-by) |
Für den Haushalt war es eine großartige Erneuerung: Ab den 1960er Jahren konnten Stoffe, Teppiche, Polstermöbel u.a. mit dem Fleckenschutzmittel Scotchgard der US-amerikanischen Firma 3M imprägniert werden. Erst als sich im Jahr 2000 herausstellte, dass der Hauptbestandteil von Scotchgard, das langkettige Perfluoroctanylsulfonat (PFOS; Abbildung 1), bereits in der Umwelt und in der menschlichen Bevölkerung nachweisbar geworden war, hat eine hektische Forschung zu möglichen Konsequenzen von PFAS, insbesondere von PFOS und PFOA, auf Mensch und Umwelt begonnen. Seit 2000 sind In der Datenbank PubMed (https://pubmed.ncbi.nlm.nih.gov//; abgerufen am 2.4.2024) jeweils rund 5000 Untersuchungen über PFOS und ebenso viele über PFOA erschienen, darunter rund 1300 zur Toxizität, etwa 1700 zur Exposition des Menschen gegenüber PFOS und PFOA und rund 300 zur Schaffung von unproblematischeren Alternativen. Eine kürzlich erschienene Arbeit gibt einen umfassenden Überblick über die Freisetzung von PFAS aus diversen Produkten und die Wege, die zur Exposition des Menschen führen ([Wee, S.Y., Aris, A.Z. (2023)]; graphisch zusammengefasst in Abbildung 2).
Die wachsende Sorge über die Umweltverschmutzung mit PFAS und die gesundheitlichen Auswirkungen von langkettigen PFAS, insbesondere PFOA und PFOS, haben zu Bemühungen geführt, die Produktionsmethoden zu regulieren und Richtlinien zur Überwachung festzulegen (im Stockholmer Übereinkommen über persistente organische Schadstoffe, https://www.pops.int/). Der größte PFAS-Produzent, die 3M Company und auch der globale Player DuPont haben die Produktion und Verwendung von PFOA uns PFOS bereits eingestellt und andere Unternehmen folgen. Allerdings gibt es - vor allem in Kontinentalasien - neue Hersteller von langkettigen PFAS.
Die Europäische Chemikalienagentur (ECHA) hat im März 2024 die nächsten Schritte für die wissenschaftliche Bewertung des Beschränkungsdossiers für PFAS vorgestellt. Der Vorschlag sieht vor, dass PFAS nur noch in Bereichen zum Einsatz kommen dürfen, in denen es auf absehbare Zeit keine geeigneten sicheren Alternativen geben wird bzw. wo die sozioökonomischen Vorteile die Nachteile für Mensch und Umwelt überwiegen. Tatsächlich gibt es ja für viele dieser Stoffe - u.a. in den Chemielabors (Schläuche, inerte Gefäße) und in der medizinischen Anwendung (Stents, Prothesen) keine offensichtlichen Alternativen.
Die Problematik der Abwägung von Risiko und alternativlosem Inverkehrbringen bestimmter PFAS-Produkte und die hohe Persistenz dieser Produkte lassen befürchten, dass PFAS noch lange Zeit unsere Böden und Gewässer kontaminieren werden.
Die PFAS- Exposition
Menschen und Tiere sind permanent PFAS-Kontaminationen ausgesetzt, viele davon sind es bereits seit Jahrzehnten. PFAS gelangen in unsere Organismen durch direkten Kontakt über die Haut oder durch Inhalation oder über den Verdauungstrakt, d.i. über kontaminierte Nahrung und Trinkwasser. Im Organismus angelangt sind langkettige PFAS praktisch nicht abbaubar, zirkulieren, werden nur sehr langsam ausgeschieden und akkumulieren, solange die Aufnahme aus kontaminierten Quellen weiter besteht. Angaben über die Verweildauer im Organismus beruhen häufig auf Schätzungen und gehen weit auseinander.
Konkretere Zahlen hat eine Studie an 106 Personen aus Ronneby (Schweden) geliefert, deren Trinkwasser von der Mitte der 1980er Jahre an mit PFAS kontaminiert war (Quelle: Löschschaum von einem nahegelegenen Flugfeld). Nach Bereitstellung von sauberem Wasser Ende 2013 wurden über 33 Monate lang die PFAS-Spiegel im Blutserum und daraus die Halbwertszeiten des Absinkens bestimmt: die Mittelwerte lagen für PFOA bei 2,7 Jahren, für PFOS bei 3,5 Jahren und für das kürzerkettige PFHxS (Perfluorohexane sulfonate) bei 5,3 Jahren.
Erschreckend hoch waren die anfänglichen Serumspiegel, die im Mittel für PFHxS bei 277 ng/ml (12 - 1 660), für PFOS bei 345 ng/ml (24 - 1 500) und für PFOA bei 18 ng/ml (2,4 - 9,2) lagen [Li Y, Fletcher T, Mucs D, et al., 2019].
Diese Serumwerte sind vor dem Hintergrund des Leitfadens der US-National Academies of Sciences, Engineering, and Medicine (16.6.2022) "Guidance on PFAS Exposure, Testing, and Clinical Follow-Up" https://www.ncbi.nlm.nih.gov/books/NBK584702/ zu sehen:
a) < 2 ng / mL , gesundheitsschädliche Wirkungen sind nicht zu erwarten;
b) 2 - 20 ng / mL , mögliche schädliche Wirkungen, insbesondere bei empfindlichen Bevölkerungsgruppen; und
c) > 20 ng / mL , erhöhtes Risiko für schädliche Wirkungen. Säuglinge und Kleinkinder gelten als besonders empfindlich gegenüber PFAS-Exposition.
Wie groß das Problem der menschlichen Exposition bereits ist, wird aus der Kontamination des Trinkwassers mit den sehr häufig verwendeten PFOA und PFOS ersichtlich, die bereits weltweit detektierbar sind. Abbildung 3 zeigt Höchstwerte, die in einzelnen Regionen gemessen wurden, wobei die US und Schweden mit ihrer umfangreichen Produktion und Konsum von PFAS Hotspots bilden [Wee S.Y., Aris, A.Z. (2023)]. Die Produktion von PFAS in diesen Ländern wurde zwar eingestellt und hat dort zu einem Absinken der Blutspiegel geführt. Dafür hat die Produktion in den Entwicklungsländern erheblich zugenommen. Emission von PFAS und Kontamination werden auch vom Wohlstand (dem BIP) der einzelnen Gebiete beeinflusst, der unmittelbar mit Produktion, Verbrauch und Entsorgung von PFAS-Produkten zusammen hängt.
|
Abbildung 3: Produktion und globale Verbreitung/Verwendung von PFOA und PFOS spiegeln sich in der Kontamination des Trinkwassers wieder. Konzentrationen in Oberflächen- und Grundwasser, in Leitungswasser und in abgefülltem Wasser sind gemessene Maximalwerte in den einzelnen Staaten und sind in erster Linie auf die anhaltende Verschmutzung durch verschiedene Erzeuger, unvollständige Beseitigungsmethoden und unzureichende Überwachung- und Managementpraktiken erklärbar. NA: keine Angaben.(Quelle: Figure 4 in Wee S.Y., Aris, A.Z. (2023) https://doi.org/10.1038/s41545-023-00274-6. Lizenz: cc-by. Grundkarte mit freundlicher Genehmigung von https://www.mapchart.net/; Lizenz cc-by-sa.) |
Die am häufigsten verwendeten PFAS werden wohl noch viele Jahre in der Umwelt gemessen werden können (insbesondere in der Nähe von Flughäfen und Militärstützpunkten), zu der Vielfalt der bereits produzierten und angewandten Tausenden anderen PFAS mit unterschiedlichen Eigenschaften fehlen ausreichend Informationen über Kontaminierungen, Expositionen und mögliche Gesundheitsrisiken und das gilt auch für die neu eingeführten PFAS-Ersatzstoffe.
Ein globales Gesundheitsproblem
Dass akkumulierende PFAS unserer Gesundheit schaden, ist unbestritten auch, wenn die Mechanismen wie und wo PFAS was bewirken noch ziemlich unbekannt sind.
PFAS sind stark lipophile Moleküle, die sich mehr und mehr in Membranen einlagern (und dort wie und was stören). Enzyme (vor allem aus den Cytochrom P450-Familien) scheitern am Versuch PFAS mittels aktiviertem Sauerstoff abzubauen. Sie setzen bloß den aktivierten Sauerstsoff (ROS) frei, der dann Entzündungsreaktionen auslöst, während PFAS-Moleküle weiter unbehelligt für Jahre im Organismus zirkulieren können und immer mehr werden.
Eine Fülle an gesundheitlichen Beeinträchtigungen wurde mit PFAS in Verbindung gebracht - vor allem Leberschäden, Krebserkrankungen im Umfeld von Produktionsstandorten mit sehr hoher Exposition, Nierenerkrankungen, Schilddrüsenerkrankungen, neurodegenerative Erkrankungen und der gesamte Komplex der Fettstoffwechselstörungen und damit verbundene Herz-Kreislauferkrankungen [Sunderland et al., 2019].
Ausreichende Evidenz für einen Zusammenhang mit der PFAS-Exposition gibt es bislang erst für wenige Krankheiten/Auswirkungen auf die Gesundheit. Die oben erwähnten "Guidance on PFAS Exposure, Testing, and Clinical Follow-Up" hat diese 2022 zusammengefasst. Es sind dies:
- verminderte Antikörperreaktion (bei Erwachsenen und Kindern),
- Fettstoffwechselstörung (Dyslipoproteinämie; bei Erwachsenen und Kindern),
- vermindertes Wachstum von Säuglingen und Föten und
- erhöhtes Risiko für Nierenkrebs (bei Erwachsenen).
Seit der Einführung der PFAS-Materialien und dem Bekanntwerden der damit für Umwelt und Gesundheit verbundenen Probleme sind Jahrzehnte ungenützt verstrichen. Dass sich die Industrie bereits viel früher über diese Risiken ihrer Erfindungen im Klaren war, ist in höchstem Maße erschreckend. Der für seine lebenslangen Forschungen über Umwelt verschmutzende Chemikalien berühmte Umweltmediziner Philippe Grandjean fasst diesen skandalösen Umstand und die zögerlichen Reaktionen der Entscheidungsträger in einem überaus kritischen, 2018 publizierten Artikel zusammen (Übersetzt aus [P. Grandjean, 2018]):
"Frühe Forschungsergebnisse über die Exposition gegenüber PFAS in der Umwelt und ihre Auswirkungen auf die Gesundheit wurden erst mit erheblicher Verzögerung verfügbar und bei den ersten Regulierungsentscheidungen zur Verringerung der Exposition nicht berücksichtigt. Erst in den letzten zehn Jahren hat sich die umweltmedizinische Forschung auf die PFAS konzentriert und wichtige Risiken für die menschliche Gesundheit, z. B. für das Immunsystem, aufgedeckt. Obwohl die Richtwerte für PFAS im Trinkwasser im Laufe der Zeit gesunken sind, sind sie immer noch zu hoch, um vor einer solchen Toxizität zu schützen. Während die am häufigsten verwendeten PFAS noch viele Jahre in der Umwelt verbleiben werden, werden neue PFAS-Ersatzstoffe eingeführt, obwohl nur wenige Informationen über negative Gesundheitsrisiken verfügbar sind. In Anbetracht der gravierenden Verzögerungen bei der Entdeckung der Toxizität von PFAS, ihrer Persistenz in der Umwelt und ihrer Auswirkungen auf die öffentliche Gesundheit sollten PFAS-Ersatzstoffe und andere persistente Industriechemikalien vor einer weit verbreiteten Verwendung einer eingehenden Forschungsprüfung unterzogen werden."
Grandjean tritt auch als Topexperte in einer 2023 erschienenen Dokumentation auf, die enthüllt, was die PFAS-Produzenten Dupont und 3M schon früh über die Risiken ihrer Verbindingen wussten. [Zembla - The PFAS Cover-up; 2023].
Zitierte Literatur:
Grandjean P. Delayed discovery, dissemination, and decisions on intervention in environmental health: a case study on immunotoxicity of perfluorinated alkylate substances. Environ Health. 2018 Jul 31;17(1):62. DOI: 10.1186/s12940-018-0405-y
Leitfaden der US-National Academies of Sciences, Engineering, and Medicine (16.6.2022) "Guidance on PFAS Exposure, Testing, and Clinical Follow-Up" https://www.ncbi.nlm.nih.gov/books/NBK584702/
Sunderland EM, Hu XC, Dassuncao C, Tokranov AK, Wagner CC, Allen JG. A review of the pathways of human exposure to poly- and perfluoroalkyl substances (PFASs) and present understanding of health effects. J Expo Sci Environ Epidemiol. 2019 Mar;29(2):131-147. DOI: 10.1038/s41370-018-0094-1
Wee, S.Y., Aris, A.Z. Revisiting the “forever chemicals”, PFOA and PFOS exposure in drinking water. npj Clean Water 6, 57 (2023). https://doi.org/10.1038/s41545-023-00274-6
Li Y, Fletcher T, Mucs D, et al. Half-lives of PFOS, PFHxS and PFOA after end of exposure to contaminated drinking water. Occup Environ Med 2018;75:46–51. doi: DOI: 10.1136/oemed-2017-104651
Ying-Cheng Huang et al., Synthesis and Biological Evaluation of an 18Fluorine-Labeled COX Inhibitor—[18F]Fluorooctyl Fenbufen Amide—For Imaging of Brain Tumors. Molecules 2016, 21, 387; doi: 10.3390/molecules21030387
Yue Pan, The Dark Side of Fluorine. ACS Med. Chem. Lett. 2019, 10, 1016−1019. DOI: 10.1021/acsmedchemlett.9b00235
Zembla - The PFAS Cover-up. Video 51.03 min. https://www.youtube.com/watch?v=y3kzHc-eV88
Verwandte Themen imScienceBlog
Redaktion, 21.03.2024: Kunststoffchemikalien: ein umfassender Report zum Stand der Wissenschaft
Roland Wengenmayr, 11.03.2021: Nachwachsende Nanowelt - Cellulose-Kristalle als grünes Zukunftsmaterial
Inge Schuster, 12.12.2014: Was macht HCB so gefährlich?
- Printer-friendly version
- Log in to post comments