Do, 19.05.2022 — Roland Wengenmayr
 Als Alessandro Volta um 1800 die Voltasche Säule erfand, ahnte er sicher nicht, dass ihn diese Ur-Batterie unsterblich berühmt machen würde. Heute ist das Volt die physikalische Einheit für die elektrische Spannung, und wir leben längst in einer elektrifizierten Kultur. Aufladbare Akkumulatoren und Einwegbatterien haben elektrische Energie praktisch überall verfügbar gemacht, das Smartphone ist unser ständiger Begleiter. Und die Elektromobilität nimmt nach der Schiene nun auch auf der Straße Fahrt auf, vom E-Roller bis zum Elektroauto. Sogar elektrisches Fliegen ist im Kommen. Der Physiker und Wissenschaftsjournalist Roland Wengenmayr gibt einen Überblick über Aufbau und Funktion von Lithium-Batterien und Ergebnisse aus dem Max-Planck-Institut für Festköperforschung (Stuttgart) zur Optimierung solcher Batterien.*
Als Alessandro Volta um 1800 die Voltasche Säule erfand, ahnte er sicher nicht, dass ihn diese Ur-Batterie unsterblich berühmt machen würde. Heute ist das Volt die physikalische Einheit für die elektrische Spannung, und wir leben längst in einer elektrifizierten Kultur. Aufladbare Akkumulatoren und Einwegbatterien haben elektrische Energie praktisch überall verfügbar gemacht, das Smartphone ist unser ständiger Begleiter. Und die Elektromobilität nimmt nach der Schiene nun auch auf der Straße Fahrt auf, vom E-Roller bis zum Elektroauto. Sogar elektrisches Fliegen ist im Kommen. Der Physiker und Wissenschaftsjournalist Roland Wengenmayr gibt einen Überblick über Aufbau und Funktion von Lithium-Batterien und Ergebnisse aus dem Max-Planck-Institut für Festköperforschung (Stuttgart) zur Optimierung solcher Batterien.*
Noch aber haben Elektroautos zwei gewichtige Nachteile im Vergleich zu Fahrzeugen mit Verbrennungsmotor: Laden dauert deutlich länger als Tanken, und eine entsprechende Reichweite erzwingt eine große, schwere „Batterie“. Das wiederum verschlechtert wegen des Ressourcenverbrauchs die Ökobilanz größerer Elektroautos. Zwar sind auch diese in ihrer Lebenszeit klimafreundlicher als die „Verbrenner“, wenn die elektrische Energie aus erneuerbaren Quellen kommt. Aber leistungsfähigere Akkumulatoren, wie die wieder aufladbaren Batterien korrekt heißen, wären ein großer Gewinn für das Klima.
Das ist das Forschungsziel der Chemikerin Jelena Popovic-Neuber am Max-Planck-Institut für Festköperforschung in Stuttgart. An den „Akkus“ gibt es noch viel zu optimieren. Selbst die besten Auto-Akkus mit Lithium-Ionen-Technologie können derzeit nur rund 0,12 Kilowattstunden (kWh) an Energie pro Kilogramm speichern. Ein Kilogramm Benzin oder Diesel enthält dagegen rund 12 kWh an nutzbarer chemischer Energie, also hundert Mal so viel Energie. Dafür allerdings sind elektrische Antriebe viel effizienter als Verbrennungsmotoren. Deshalb müssen Elektroautos deutlich weniger elektrische Energie an Bord mitführen, um auf vergleichbare Fahrleistungen zu kommen. Also muss die Forschung die spezifische Energiedichte der Akkus gar nicht auf das Niveau von fossilem Treibstoff steigern.
Akkumulatoren, Einweg-Batterien sowie Brennstoffzellen, die ebenfalls in Stuttgart erforscht werden, zählen zu den elektrochemischen Zellen. Deren Elektrochemie ist ein Forschungsthema der Abteilung von Joachim Maier, Direktor am Max-Planck-Institut für Festkörperforschung in Stuttgart. Maier interessiert sich schon sehr lange für das Verhalten von zum Beispiel Lithium-Ionen in solchen Zellen und gründete ein Forschungsgebiet, das Nano-Ionik heißt. Jelena Popovic-Neuber leitet bei ihm ein Team, das neue Ideen für effizientere Akkus auf Basis von Lithium und anderen Alkali- sowie Erdalkalimetallen entwickelt. Es ist Grundlagenforschung mit direkter Verbindung zur technischen Anwendung. Sogar einige Patente halten die Stuttgarter.
Lithium ist das dritte Element im Periodensystem. Man kann das silbrige Metall allerdings nicht einfach in die Hand nehmen. Es muss unter Paraffinöl oder in trockenem Argon-Schutzgas aufbewahrt werden, denn es reagiert schon mit Spuren von Wasser und Sauerstoff. Darin ist es seinem schwereren Vetter Natrium ähnlich. Auch Natrium eignet sich für Batterietechnologien, das Stuttgarter Team arbeitet damit ebenfalls. Es hat den Vorteil, dass es auf der Erde viel häufiger als Lithium vorkommt und leichter ohne negative ökologische und soziale Folgen gewonnen werden kann. „In China kommen 2023 erste Natrium-Akkus für Autos auf den Markt“, erzählt Jelena Popovic-Neuber.
Im Periodensystem der Elemente steht Lithium noch oberhalb von Natrium auf der „Linksobenaußen“-Position, unterhalb von Wasserstoff. Es ist generell ein chemischer Extremist. Für Hochleistungsakkus ist es aus zwei Gründen attraktiv: Erstens ist das Atom winzig und damit ein Leichtgewicht. Das steigert die speicherbare Menge an elektrischer Ladung pro Kilogramm Akku und damit Energie. Zweitens verhält sich Lithium innerhalb der elektrochemischen Spannungsreihe – dem Laufsteg der elektrochemischen Elemente – besonders „elektropositiv“. Es ist somit ein williger Elektronenspender. Aber warum ist das für Akkus gut?
Dazu muss man wissen, dass die zweite Stellschraube zur Optimierung der Speicherkapazität die elektrische Spannung zwischen dem Plus- und dem Minuspol ist. Je höher diese Zellspannung ist, desto mehr elektrische Energie passt im Prinzip in den Akku. Und hier kommt die Spannungsreihe ins Spiel: Würde man eine Lithium-Elektrode an eine Standard-Wasserstoffelektrode anschließen, die die Null-Volt-Linie markiert, läge das Lithium bei minus 3,04 Volt. Das ist Rekord in der Spannungsreihe. Wenn man nun leistungsfähige Akkus entwickeln will, paart man den Elektronenspender Lithium mit einem möglichst gierigen Elektronenempfänger am anderen Pol der Zelle. Dann sind Zellspannungen über 5 V erreichbar! Zum Vergleich: Handelsübliche Lithium-Ionen-Akkuzellen liegen derzeit bei 3,6 bis 3,8 V, Alkali-Einwegbatterien bei nur 1,5 V.
Einfach und schnell speichern
Die theoretisch höchstmögliche Zellspannung liegt bei fast 6 V. Dazu müsste man Lithium mit seinem extremsten Gegenspieler verkuppeln: Fluor, das elektronegativste Element. Nach dieser Überlegung würde also der stärkste aller Akkus eine Elektrode besitzen, in die Fluorgas geleitet wird. Die andere Elektrode wäre ein Klotz aus Lithiummetall, denn so wäre das Lithium am dichtesten zusammengepackt. Ein solcher Lithium-Fluor-Akku käme theoretisch auf eine spezifische Energiedichte von fast 10 kWh/kg. Er wäre mit Diesel und Benzin konkurrenzfähig. Allerdings ist Fluor so reaktiv, korrosiv und giftig, dass niemand ernsthaft einen solchen Akku bauen wollte.
Wiederaufladbare Akkus werden über einen Elektronenstrom geladen. Beim Entladen liefern sie einen entgegengesetzten Elektronenstrom, der Arbeit leistet. Dabei benötigen Laden und Entladen jeweils eine gewisse Zeit. Das liegt daran, dass Akkus die elektrische Energie zum Speichern erst in chemische Energie umwandeln müssen. Beim Entladen machen sie das wieder rückgängig.
Beim Laden werden die Elektronen mit einer zweiten Sorte elektrischer Ladungsträger zusammengebracht: positiv geladene Ionen, zum Beispiel Lithium-Kationen, denen im Vergleich zu den Lithium-Atomen jeweils ein Elektron fehlt. In Akkus sind diese positiven Ladungsträger beweglich. Die Ionen fließen im Zellinneren zwischen beiden Elektroden, wobei zwischen Laden und Entladen ihre Fließrichtung wechselt. Für die Ionen-Rennbahn sorgt ein flüssiger oder fester Elektrolyt. Der Elektrolyt muss einerseits die positiven Ionen möglichst gut leiten, andererseits die negativen Elektronen wie ein Isolator blockieren. Sonst würden die Elektronen kurzerhand durch das Zellinnere flitzen, anstatt im äußeren Stromkreis mühsam zu arbeiten. So ein interner Kurzschluss kann bei leistungsfähigen Akkus richtig gefährlich werden.
Mehr Platz für Energie
|
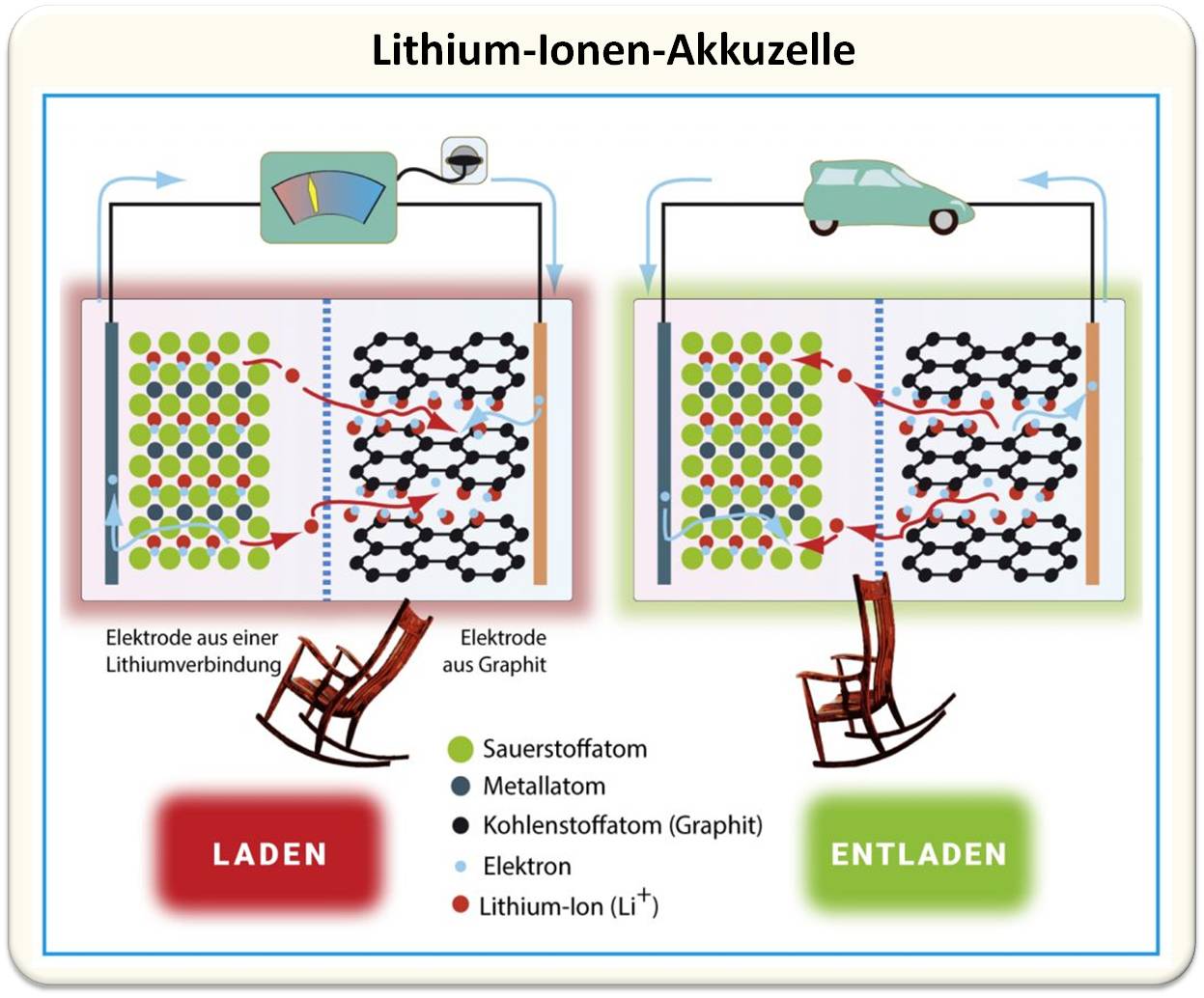
Abbildung 1: Funktionsprinzip einer Lithium-Ionen-Akkuzelle: Beim Laden „pumpt“ das Ladegerät im äußeren Stromkreis Elektronen (blaue Kugeln und Pfeile) von der in der Abbildung linken in die rechte Elektrode – und damit auch elektrische Energie. Im Inneren der Zelle wandern die Lithium-Ionen (rote Kugeln und Pfeile) von der linken Elektrode hinüber und lagern sich zwischen den Graphitschichten (schwarz) der rechten Elektrode ein. Beim Entladen kehren sich die Vorgänge um. Die Hin- und Herbewegung der Lithium-Ionen beim Laden und Entladen heißt Schaukelstuhl-Effekt. Die für die Ionen durchlässige Separatormembran (blau gestrichelte Linie) verhindert einen direkten Kontakt der Elektroden, also einen Kurzschluss.© R. Wengenmayr / CC BY-NC-SA 4.0 |
Jede Batterie- und Akkusorte hat ihre ganz eigene, oft komplizierte Elektrochemie. Beim Lithium-Ionen-Akku ist zumindest das chemische Grundprinzip einfach zu verstehen. Beim Laden des Akkus pumpt das Ladegerät Elektronen von der Lithiumverbindung-Elektrode in die Graphit-Elektrode, während gleichzeitig im Inneren der Batterie Lithium-Ionen durch den Elektrolyt zur Graphit-Elektrode fließen. Beim Entladen werden Elektronen an den Leiterdraht abgegeben, die über den äußeren Stromkreis zur Lithiumverbindung-Elektrode wandern. Im Inneren des Akkus wandern gleichzeitig Lithium-Ionen von der Graphit-Elektrode durch den Elektrolyt zur Lithiumverbindung-Elektrode (Abbildung 1).
Eine Elektrode besteht bei den etablierten Lithium-Ionen-Akkus aus Graphit. Es kann Lithium-Ionen wie ein Schwamm aufnehmen und trägt so maßgeblich zur hohen Speicherkapazität bei. Graphit ist aus mehreren Ebenen mit wabenförmigen Kohlenstoff-Sechserringen aufgebaut. Die kleinen Lithium-Ionen können in diese Ebenen wie in ein Parkhaus hineinfahren und dort chemisch einparken. Dabei bilden sie mit den ankommenden Elektronen in den Zwischenräumen zwischen den Kohlenstoff-Ebenen eine sogenannte Interkalationsverbindung (Abbildung 1, links).
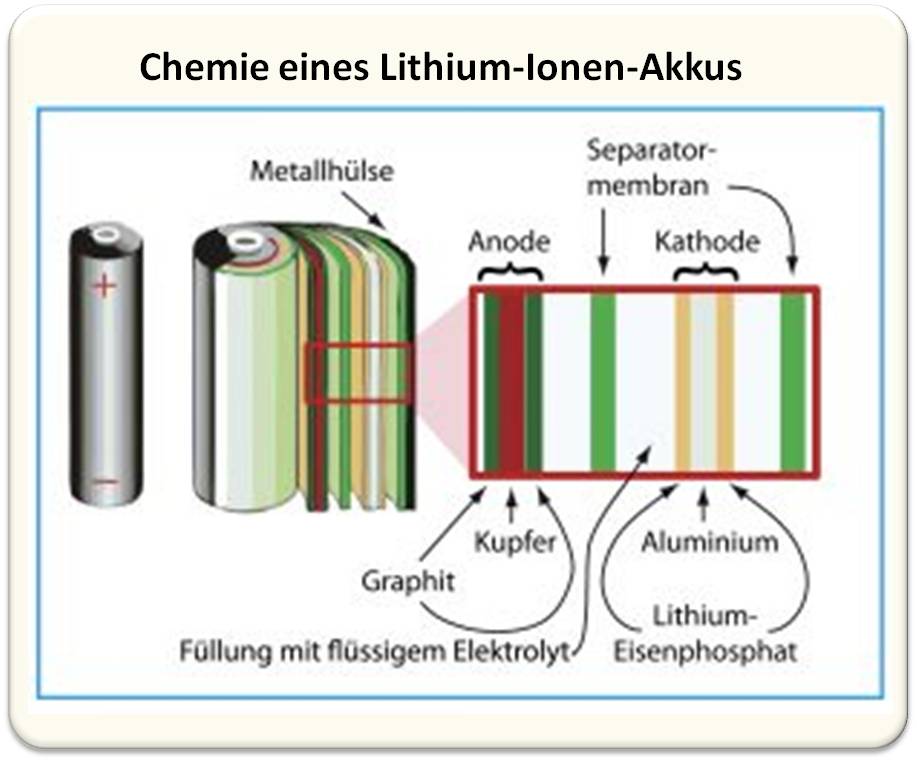
Die andere Elektrode besteht in der Regel aus einer geeigneten Lithiumverbindung, die ebenfalls wie ein Schwamm für Lithium-Ionen wirkt. Bei kommerziell verbreiteten Zellen ist das oft noch Lithium-Cobaltoxid. Doch große Hersteller wie Tesla stellen zunehmend auf Lithium-Eisenphosphat um (Abbildung 2) und ersetzen so das umweltschädliche und seltene Cobalt. Das meiste Cobalt wird im Kongo abgebaut, oft unter menschenunwürdigen Bedingungen und großen Umweltschäden.
|
Abbildung 2: Aufbau einer Lithium-Ionen-Akkuzelle mit einer umweltfreundlichen Lithium-Eisenphosphat-Elektrode. In ihr laufen beim Laden und Entladen Redoxreaktionen ab, deren komplexe Mechanismen im Detail noch diskutiert werden. Einflussfaktoren sind zum Beispiel die Partikelgröße von LiFePO4 in der Verbundelektrode oder das verwendete Lösungsmittel. © R. Wengenmayr / CC BY-NC-SA 4.0 |
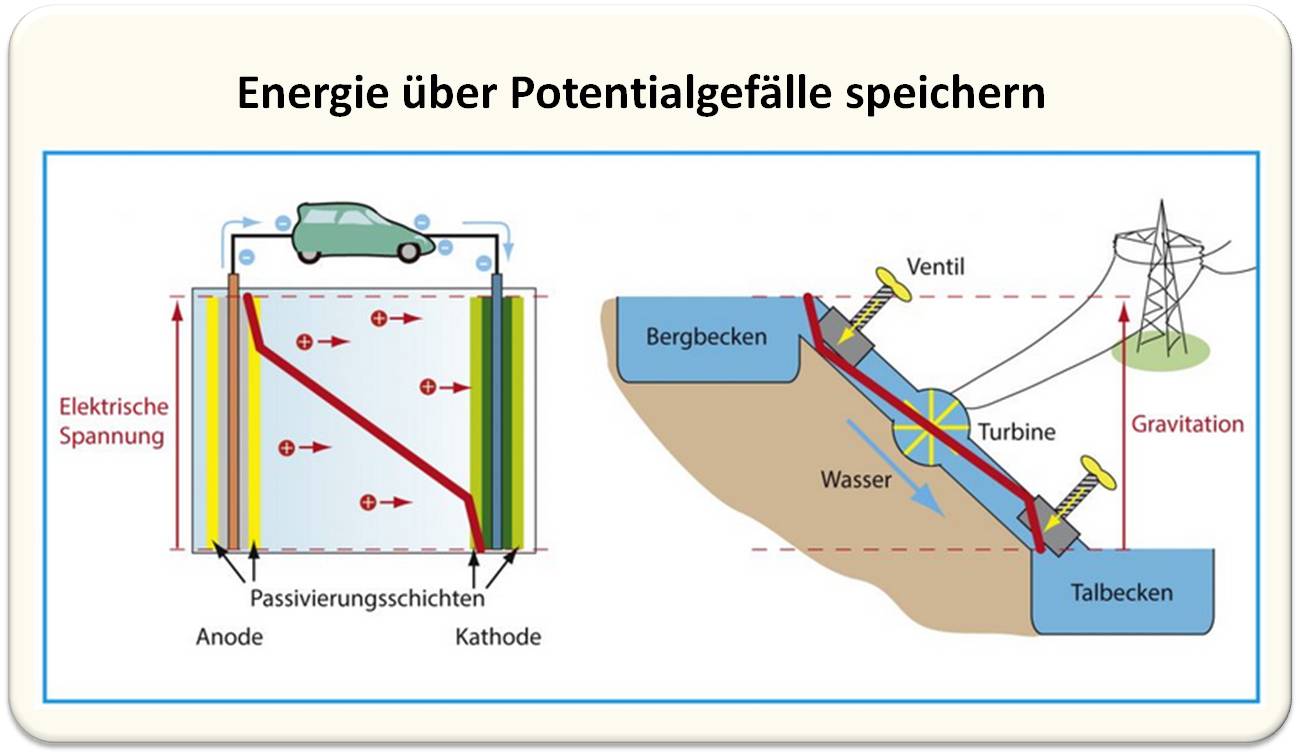
Neuartige Materialkombinationen für Elektroden und Elektrolyt sollen die Lithium basierten Akkus verbessern. Höhere Zellspannungen werfen dabei neue Probleme auf. Mehr als etwa 3,5 V hält nämlich kein Elektrolyt aus, ohne sich zu zerlegen. Zum Glück bilden sich beim allerersten Laden der Zelle Passivierungsschichten um die Elektroden. Diese schützen einerseits das Elektrodenmaterial vor dem chemisch aggressiven Elektrolyt. Andererseits reduzieren sie die elektrische Spannung, der der Elektrolyt direkt ausgesetzt ist. Der Clou: Trotzdem verbessert die hohe Zellspannung die Speicherfähigkeit. Um zu verstehen, wie das im Prinzip funktioniert, hilft der Vergleich mit den größten Speichern für elektrische Energie: Pumpspeicher-Wasserkraftwerke (Abbildung 3).
|
Abbildung 3: Energie über Potenzialgefälle speichern. Sowohl beim Lithium-Ionen-Akku (links) als auch einem Pumpspeicher-Wasserkraftwerk gibt es ein sogenanntes Potenzialgefälle (breite rote Linien): Beim Akku ist es die elektrische Spannung, beim Wasserkraftwerk die Energiedifferenz des Wassers im oberen und unteren Becken. Beim Akku sorgen die Passivierungsschichten um die Elektroden für einen „Spannungsabfall“ (kurze rote Linienstücke, die steiler verlaufen), der den Elektrolyt schützt. Analog schützen beim Kraftwerk zwei Reduzierventile oben und unten das Fallrohr vor zu heftig strömendem Wasser.© R. Wengenmayr / CC BY-NC-SA 4.0 |
Entklumpter Elektrolyt
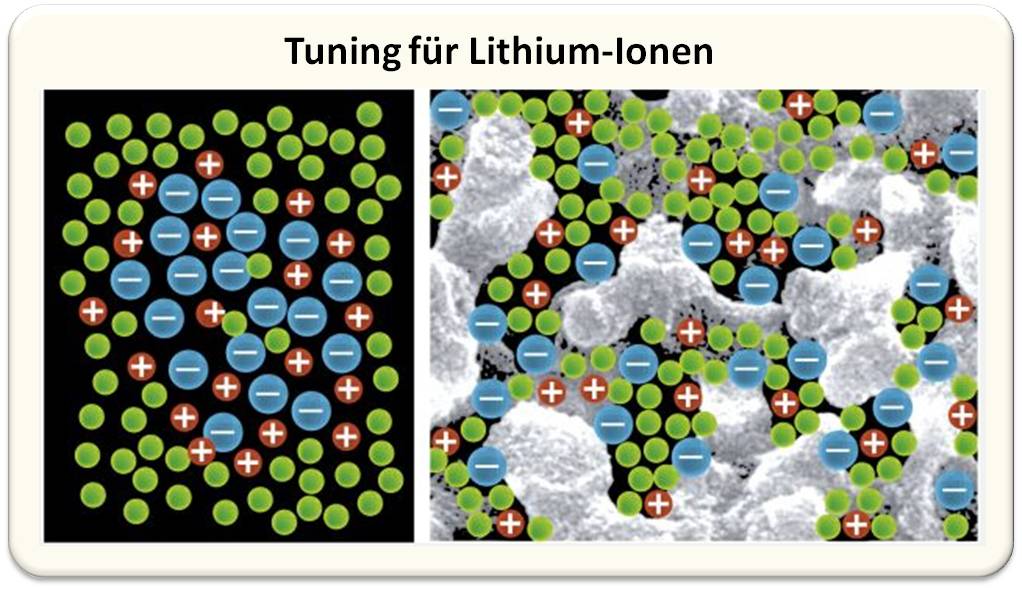
Der Elektrolyt besteht aus Lithiumsalzen in einem organischen Lösemittel. Wasser scheidet nicht nur wegen des Lithiums aus, es zersetzt sich überdies ab einer Spannung von 1,2 V. Die komplexe Flüssigkeit enthält einfach positiv geladene Lithium-Ionen und eine entsprechende Anzahl negativer Ladungsträger, zum Beispiel Hexafluorphosphat-Anionen (PF6–). Zwischen ihnen herrschen starke elektrische Anziehungskräfte, weshalb beide Ionen-Sorten sich gerne zusammenlagern. So bleibt der Elektrolyt elektrisch neutral, was verhindert, dass er sich zersetzt und technische Probleme verursacht. Leider werden die Lithium-Ionen im Klammergriff der Anionen ziemlich unbeweglich. Das behindert den Ladungstransport in der Zelle und vernichtet einen Teil ihrer gespeicherten Energie. Jedes positiv geladene Ion ist zudem von einer Hülle negativ geladener Anionen umgeben, und solche Gebilde können sich aneinander lagern, was die Lithium-Ionen in ihrer Bewegung durch den Elektrolyt behindert (Abbildung 4, links).
Man kann sich das wie die Fans zweier gegnerischer Fußballmannschaften vorstellen, die wild durcheinander zu zwei verschiedenen Aufgängen im Stadion streben. Sie ziehen sich auch noch gegenseitig an, was natürlich zu Reibereien führt. Kurzum: Der Strom ins Stadion droht zu stocken, weshalb der Veranstalter Ordner einsetzt. Diese halten die Fans einer Mannschaft fest, um die gegnerischen Fans schnell in ihren Block zu schleusen. Genau diese Idee hatten die Stuttgarter. Sie mischten extrem feine, nur zehn bis hundert Nanometer (Milliardstel Meter) winzige Partikel in den Elektrolyten. Diese sind zum Beispiel aus Siliziumdioxid, also Nanosand! Die Sandkörnchen wirken als Ordner: Da ihre Oberfläche elektrisch positiv geladen ist, binden sie einen Teil der Anionen an sich. Das befreit zusätzliche Lithium-Ionen. Die größere Menge an (fast) ungehindert fließenden Lithium-Ionen senkt den elektrischen Widerstand des Elektrolyten deutlich. Das verringert den Energieverlust im Akku und beschleunigt das Laden und Entladen.
Auf den Trick mit dem Nanosand kam Joachim Maier vor einigen Jahren. Allerdings hat der feine Sand in dem flüssigen Elektrolyten auch Nachteile, zum Beispiel kann er sich unten im Akku absetzen. „So ein System lässt sich nur schwer mit reproduzierbaren Eigenschaften herstellen“, erklärt Jelena Popovic-Neuber. Das ist aber Voraussetzung für die industrielle Anwendung. Es gibt jedoch eine Lösung, an der ihr Team forscht. Aus den Oxiden von Silizium und Aluminium, SiO2 und Al2O3, lässt sich mit einem speziellen chemischen Verfahren eine Art mineralischer „Hartschaum“ herstellen. Dieses Material ist durchzogen von mikro- bis nanoskopisch kleinen Poren und Kapillaren. „Das legen wir über Nacht in die Elektrolytlösung ein, damit es sich vollsaugt“, erklärt die Forscherin. Danach funktioniert dieser Festelektrolyt im Prinzip wie der Nanosand – jetzt aber wie Sand, dessen Körner im Raum fixiert sind und damit nicht mehr der Schwerkraft folgen können (Abbildung 4, rechts). Das bringt die nötige Stabilität ins Spiel.
|
Abbildung 4: Links: Im flüssigen Elektrolyten einer normalen Akkuzelle sind die Lithium-Ionen (rot) zwischen negativ geladenen Anionen (blau) des Elektrolyts nahezu gefangen (grün: Lösemittelteilchen). Das behindert ihre Bewegung. Rechts: Die Mikro- und Nanokanäle im Festelektrolyten (grau) aus SiO2 oder Al2O3 binden die Anionen an ihren elektrisch positiv geladenen Oberflächen. Das setzt mehr Lithium-Ionen für den Ladungstransport zwischen den Elektroden frei. Der Akku arbeitet effizienter.© R. Wengenmayr / CC BY-NC-SA 4.0 |
Das Rätsel der Grenzflächen
So ein Festelektrolyt hat auch noch einen weiteren Vorteil, der zu Popovic-Neubers zweitem Forschungsgebiet führt. Das befindet sich in der schon erwähnten Passivierungsschicht auf den Oberflächen des Elektrodenmaterials. Die Forscherin will nämlich zurück zu den Wurzeln der Lithium-Akkus, und diese hatten ursprünglich metallische Lithiumelektroden. Der Vorteil besteht darin, dass das Lithium im Metall wesentlich dichter gepackt und außerdem extrem leicht ist. Also können solche Akkus theoretisch mehr Energie pro Kilogramm Gewicht speichern. Allerdings gab es bei den ersten Generationen in den 1980er-Jahren Unfälle, bei denen metallische Lithium-Akkus explodiert und in Brand geraten sind. Wegen dieser Gefahr verschwanden solche Akkus wieder vom Markt. Als sichere Alternative wurden Lithium-Ionen-Akkus mit Graphit-Elektroden entwickelt.
Das Problem der metallischen Elektroden liegt grundsätzlich darin, dass die Ionen einerseits Ladungsträger, andererseits Material sind. Sobald ein Lithium-Ion ein Elektron einfangen kann, wird es zu einem Metallatom. Die Gefahr: Metallisches Lithium kann sich an Stellen im Akku abscheiden, wo es stört oder gefährlich wird. So können zum Beispiel feine Metall-„Filamente“ wie Tropfsteine wachsen, bis sie eine elektrische Brücke zwischen den Elektroden herstellen. Die Folge ist ein Kurzschluss, der den Akku zerstört.
Wie solche unerwünschten Metallstrukturen entstehen, ist ziemlich kompliziert und deshalb bis heute nicht im Detail verstanden. Ihr Gegenspieler ist eine schützende Passivierungsschicht, die auf der Oberfläche einer metallischen Lithiumelektrode durch chemische Reaktion mit der Elektrolytlösung wächst. Sie ist sehr komplex aus vielen mikroskopischen Körnchen aufgebaut, die chemisch unterschiedlich zusammengesetzt sind. Daher ist es schwierig, ganz genau herauszufinden, wie eine unerwünschte Metallstruktur diese Schicht durchdringt.
Die Passivierungsschicht ist wie schon erwähnt wichtig, um die Elektrode ausreichend vom Elektrolyten zu trennen. Auf der anderen Seite muss diese Schicht durchlässig für die Lithium-Ionen sein. Sie darf auch im Lauf der Lade- und Entladezyklen nicht zu schnell weiterwachsen, weil das den Akku altern lässt. Das unerwünschte Schichtwachstum lässt sich zum Beispiel durch Einsatz eines sehr dünnen Festelektrolyten verhindern. Weil dieser mechanisch stabil ist, kann der „Sandwich“ Elektrode-Elektrolyt-Elektrode im Akkupack zusammengepresst werden. Das bremst einen unerwünschten Zuwachs der Passivierungsschicht.
Im Labor zeigt Jelena Popovic-Neuber zwei große Plexiglaskästen. Einer der beiden Kästen ist für Experimente mit Lithium, der andere für Natrium. Vorne gibt es jeweils zwei Öffnungen, durch die man in armlange, schwarze Handschuhe schlüpfen und so im Kasten hantieren kann. Die Kästen sind mit dem trockenen Edelgas Argon geflutet, um die Alkalimetalle vor dem Kontakt mit Luft zu schützen. Die Forscherin zeigt ein Stück Natrium, aus der mit einem Locheisen runde Stücke für Elektroden gestanzt werden. Daneben liegt eine zusammengeschraubte Testzelle. Spezielle elektrische Messungen, sogenannte Impedanzmessungen, verraten dem Team, wie die Grenzschicht auf den Elektroden chemisch und physikalisch aufgebaut ist.
Aber nicht nur für Alkalimetalle, auch für Erdalkalimetalle interessiert sich Jelena Popovic-Neuber. Magnesium- und Calcium-Ionen erlauben zwar nicht so hohe elektrische Spannungen wie Lithium, dafür kann jedes Ion eine zweifache positive Ladung tragen. „So kann man eine höhere Energiedichte erreichen“, sagt sie. Für bessere Akkus sind also viele Lösungen denkbar. Für Forschung und Entwicklung sind das elektrisierende Zukunftsaussichten.
* Der Artikel ist erstmals unter dem Title: " Eine volle Ladung Energie – elektrisierende Ideen für leistungsfähigere Akkus" https://www.max-wissen.de/max-hefte/techmax-13-akkumulatoren/ in TECHMAX 13 (aktualisiert Frühjahr 2022) der Max-Planck-Gesellschaft erschienen und steht unter einer CC BY-NC-SA 4.0 Lizenz. Mit Ausnahme des verkürzten Titels wurde der Artikel wurde unverändert in den Blog übernommen.
Weiterführende Links
Matthias Kühne et al., 2016: Lithium ultraschnell zwischen zwei Graphenlagen. https://www.mpg.de/10977209/mpi-fkf_jb_20161?c=10583665&force_lang=de
Agora Verkehrswende (2019), Klimabilanz von Elektroautos. Einflussfaktoren und Verbesserungspotenzial, 2019: https://www.agora-verkehrswende.de/fileadmin/Projekte/2018/Klimabilanz_von_Elektroautos/Agora-Verkehrswende_22_Klimabilanz-von-Elektroautos_WEB.pdf
Alexander Freund , 2020: Natrium statt Lithium: Die Akkus der Zukunft. https://www.dw.com/de/natrium-statt-lithium-die-akkus-der-zukunft/a-54512116
Joachim Maier, 2011: Die Ausnützung von Größeneffekten für die elektrochemische Energieumwandlung. https://www.mpg.de/4647190/Elektrochemische_Energieumwandlung?c=11659628 und: Pioniere zwischen den Polen. https://www.mpg.de/1327542/lithiumbatterien
Artikel im ScienceBlog
IIASA, 24.03.2022: Anstelle von Stauseen, Staumauern, Rohrleitungen und Turbinen: Elektro-Lkw ermöglichen eine innovative, flexible Lösung für Wasserkraft in Bergregionen
Inge Schuster, 05.03.2021: Trojaner in der Tiefgarage - wenn das E-Auto brennt
Georg Brasseur,10.12.2020: Die trügerische Illusion der Energiewende - woher soll genug grüner Strom kommen?
Georg Brasseur, 24.09.20: Energiebedarf und Energieträger - auf dem Weg zur Elektromobilität
Erich Rummich, 02.08.2012: Elektromobilität - Elektrostraßenfahrzeuge
- Printer-friendly version
- Log in to post comments