Phagen und Vakzinen im Kampf gegen Antibiotika-resistente Bakterien
Phagen und Vakzinen im Kampf gegen Antibiotika-resistente BakterienDo, 08.7.2021 — Redaktion
Die Entstehung von Antibiotika-resistenten Bakterien, die derzeit bereits rund 700 000 Menschen jährlich töten und der Mangel an neuen wirksamen Antibiotika hat das Interesse an einer Phagentherapie wieder aufleben lassen. Worum es dabei geht hat und dass diese Therapieform leider noch in den Kinderschuhen steckt, hat die renommierte Virologin Karin Moelling vor zwei Jahren im ScienceBlog berichtet [1, 2]. Nun entwickelt das französische Unternehmen Pherecydes Pharma - unterstützt durch das EU-Projekt PhagoProd – verbesserte qualitätskontrollierte Verfahren zur Selektion, Produktion und klinischen Anwendung von Phagen. Ein weiteres EU-Projekt BactiVax möchte Infektionen vorbeugen und Vakzinen gegen geeignete Zielproteine an der Bakterienoberfläche entwickeln.*
Anlässlich seines Nobelpreisvortrags über die Entdeckung des Penicillins im Dezember 1945 hat Dr. Alexander Fleming davor gewarnt, dass Bakterien gegen das Medikament resistent werden könnten, sofern sie nicht tödlichen Mengen ausgesetzt würden. „Es ist nicht schwierig, Mikroben im Labor gegen Penicillin resistent zu machen, indem man sie Konzentrationen aussetzt, die nicht ausreichen, um sie abzutöten, und das gleiche ist gelegentlich im Körper passiert“, sagte er.
Seine Warnung erwies sich als weitblickend. Heutzutage sind viele Bakterien gegen mehrere Antibiotika resistent und damit infizierte Patienten daher schwer zu behandeln. Dies passiert, weil Bakterien bei Anwendung von Antibiotika Wege entwickeln, um deren Wirkung zu eliminieren, zu blockieren oder zu umgehen.
Die Folgen für die menschliche Gesundheit sind schwerwiegend. Jedes Jahr sterben schätzungsweise 700.000 Menschen an antibiotikaresistenten Keimen. Die Weltgesundheitsorganisation (WHO) prognostiziert, dass bis 2050 an die 10 Millionen Todesfälle pro Jahr erreicht werden, wenn sich nichts ändert [3].
Erschwerend kommt hinzu, dass wir neue Antibiotika nicht schnell genug entwickeln. Von 43 in der Entwicklung befindlichen Antibiotika handelt es sich laut einer aktuellen WHO-Überprüfung nicht um neuartige Medikamente, die eine Gruppe von prioritären arzneimittelresistenten Bakterien adäquat bekämpfen. Tatsächlich wurde seit den 1980er Jahren keine neue Klasse von Antibiotika auf den Markt gebracht, die die problematischsten Bakterien bekämpft, die meistens einer Gruppe von sogenannten Gram-negativen Bakterien angehören.
„Die niedrig hängenden Früchte sind bereits gepflückt. Jetzt wird es mehr und mehr schwierig neue Antibiotika zu entdecken“, sagte Dr. Guy-Charles Fanneau de la Horie, CEO von Pherecydes Pharma, einem Biotech-Unternehmen in Frankreich.
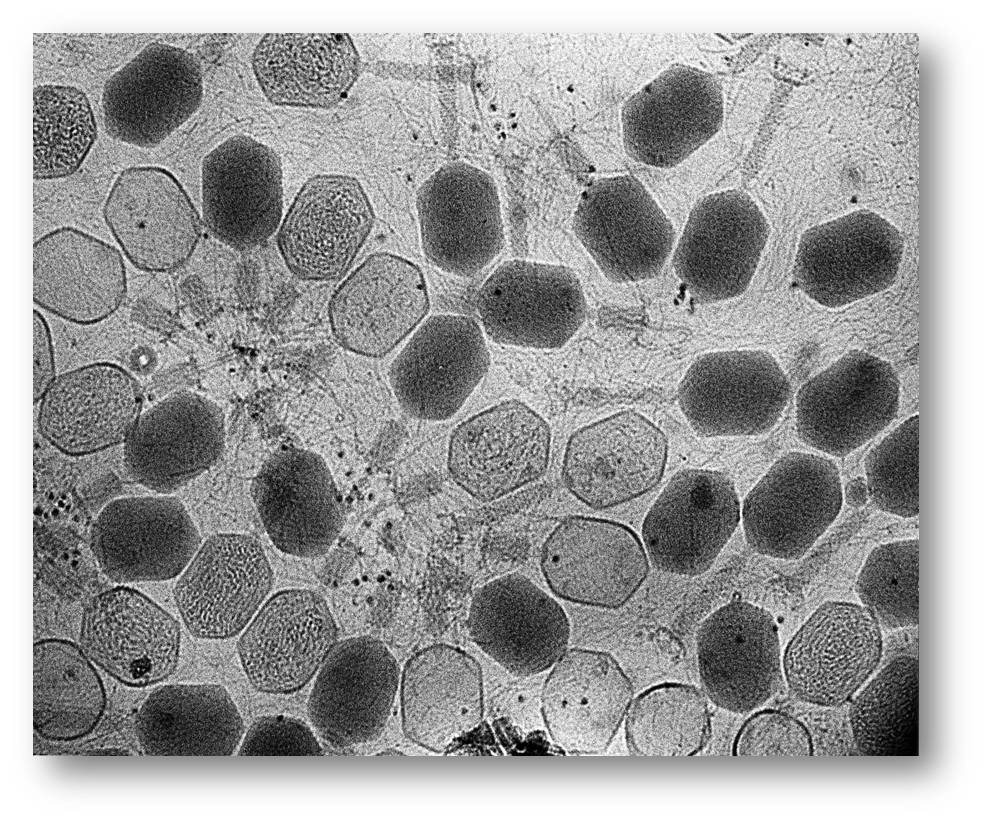
Eine Alternative zur Suche nach neuen Medikamenten ist die Verwendung von Viren, die als Bakteriophagen (oder Phagen) bezeichnet werden und deren Opfer Bakterien sind. Abbildung 1. Sobald Phagen auf Bakterien landen, injizieren sie diesen ihre DNA und replizieren sich in ihnen. Bald platzen daraus ganze Virushorden hervor, um weitere Bakterien zu infizieren.
|
Abbildung 1.Bakteriophagen (oder Phagen) erbeuten Bakterien. Sobald Phagen auf Bakterien landen, injizieren sie ihnen DNA und replizieren sich in ihnen. Bildnachweis - ZEISS Microscopy, lizenziert unter CC BY-NC-ND 2.0 |
Keimtötende Viren
Pherecydes, das Unternehmen von Dr. de la Horie, ist auf die Herstellung solcher Phagen fokussiert und deren Anwendung an Patienten, die mit arzneimittelresistenten Bakterien infiziert sind. Seine Phagen töten drei Bakterienarten, die für ihre Resistenz gegen sogenannte first-line Antibiotika bekannt sind – Staphylococcus aureus, Escherichia coli und Pseudomonas aeruginosa. Dies sind die Hauptverantworlichen für viele arzneimittelresistente Infektionen in Krankenhäusern, wo ja die gefährlichsten Keime leben, merkt Dr. de la Horie an.
Die Anwendung von Phagenviren an Patienten sollte absolut sicher sein, da diese menschliche Zellen ja nicht angreifen. Und im Gegensatz zu vielen Antibiotika, die gegen Massen von Bakterienarten wirken, sind Phagen gezielter und töten keine „freundlichen“ Mikroben in unserem Darm. „Sie sind sehr spezifisch“, sagt Dr. de la Horie. „Beispielsweise hat ein Phage, der S. aureus abtötet, keine Wirkung auf Pseudomonas.“
Damit er eine präzise Waffe zur Abtötung entsprechender Bakterien ist, muss ein passender Phage sorgfältig ausgewählt werden. Dementsprechend hat Pherecydes den Kriterien der Qualitätskontrolle unterliegende Labors ("GMP-Konformität) etabliert, um Patientenproben zu analysieren, Problemkeime zu prüfen und einen spezifischen Phagen auszuwählen, um diese abzutöten.
„Wir haben eine kleine Anzahl von Phagen entdeckt, die wir Superphagen nennen, weil sie gegen eine Vielzahl von Stämmen derselben Spezies aktiv sind“, sagt Dr. de la Horie. Wenn ein Patient Pseudomonas aeruginosa hat, einen bösartigen Keim, der Patienten an Beatmungsgeräten häufig infiziert, werden Phagen angewandt, die mehr als 80% der Stämme abtöten
Die Phagentherapie ist von der Europäischen Arzneimittel-Agentur (EMA) noch nicht zugelassen. Pherecydes hat allerdings Patienten nach der Option „compassionate use“ mit Phagen behandelt, die nach Knie- oder Hüftoperationen Infektionen mit arzneimittelresistenten Bakterien entwickelten und bei denen andere Behandlungsmöglichkeiten versagten. Es sind dies Infektionen, die besonders schwer mit Antibiotika zu behandeln sind und kein gerade kleines Problem darstellen. „Zwischen 2 % bis 5 % der Gelenkersatzteile für Hüfte und Knie infizieren sich“, erklärt Dr. de la Horie.
Bis jetzt hat das Unternehmen mehr als 26 Patienten mit Phagen behandelt, hauptsächlich im Hospices Civils de Lyon (der sehr großen, zweiten Universitätsklinik Frankreichs). Berichte zeigen beispielsweise, wie dort drei ältere Patienten mit einer S. aureus-Infektion der Knieprothesen sowie ein Patient mit persistierender Pseudomonas-Infektion behandelt wurden. Es ist geplant, noch in diesem Jahr eine Studie zu Gelenkinfektionen nach Hüft- und Knieoperationen zu starten.
Außerdem hat das Unternehmen – unterstützt durch das EU-Projekt PhagoProd [4]– verbesserte Herstellungsverfahren für Phagen entwickelt. Nun werden Litermengen hergestellt, es ist aber geplant, dies auf Chargen von mehreren zehn Litern zu erhöhen. Ein Milliliter in einer Flasche kann 10 Milliarden Phagen enthalten.
Dazu kommt: Wenn Phagen einem Patienten injiziert oder auf infiziertes Gewebe aufgebracht werden, vermehren sie sich in den Zielbakterien, sodass später mehr von ihnen zum Abtöten von Bakterien zur Verfügung stehen. „Sobald man die Phagen mit Bakterien in Kontakt gebracht hat, braucht man keine Phagen mehr zuzufügen, da sie sich selbst vermehren“, sagt Dr. de la Horie.
Dr. de la Horie hofft, dass 2023 eine große Patientenstudie beginnen kann. „Wir glauben, dass unsere Produkte frühestens 2024 oder vielleicht 2025 auf den Markt kommen könnten“, sagt er.
Vorbeugen, nicht heilen
Mit der Herausforderung antibiotikaresistenter Infektionen befasst sich auch BactiVax [5], ein weiteres EU-Projekt, zu dessen Zielen u.a. einer der Problemkeime – Pseudomonas aeruginosa – gehört. Abbildung 2. Anstatt Phagen oder andere Methoden anzuwenden, um Infektionen in ihrer Entstehung zu behandeln, setzen die BactiVax -Forscher jedoch auf Impfstoffe.
|
Abbildung 2.Das EU-Projekt Bactivax - Impfungen gegen Problemkeime. https://www.bactivax.eu/the-project |
Pseudomonas peinigt Patienten auf der Intensivstation, Patienten mit chronisch obstruktiver Lungenerkrankung (COPD) und Patienten mit Mukoviszidose.
Pseudomonas kann chronische Infektionen und auch schwere Infektionen verursachen. „Es ist ein ziemlich häufig vorkommender Keim, der manchmal auch nicht wirklich Schaden zufügt", sagt Irene Jurado, Doktorandin am University College Dublin in Irland, „aber für Menschen mit Grunderkrankungen kann er ein Problem sein.“
Wenn ein Kind mit Mukoviszidose im Alter von 5 oder 6 Jahren mit einigen solcher Stämme infiziert wird, kann der Keim ein Leben lang in der Lunge verbleiben, die Atmung schwierig machen und schwer krank machen, fügt sie hinzu.
Pseudomonas besitzt ein großes Genom, das ihm viel Flexibilität verleiht sich an verschiedene Herausforderungen anzupassen (darüber hat Jurado kürzlich berichtet). Dies macht Pseudomonas besonders gewandt, um Antibiotikaresistenzen zu entwickeln. So haben Forscher zwar jahrzehntelang versucht, Impfstoffe gegen Pseudomonas zu entwickeln, sind aber erfolglos geblieben.
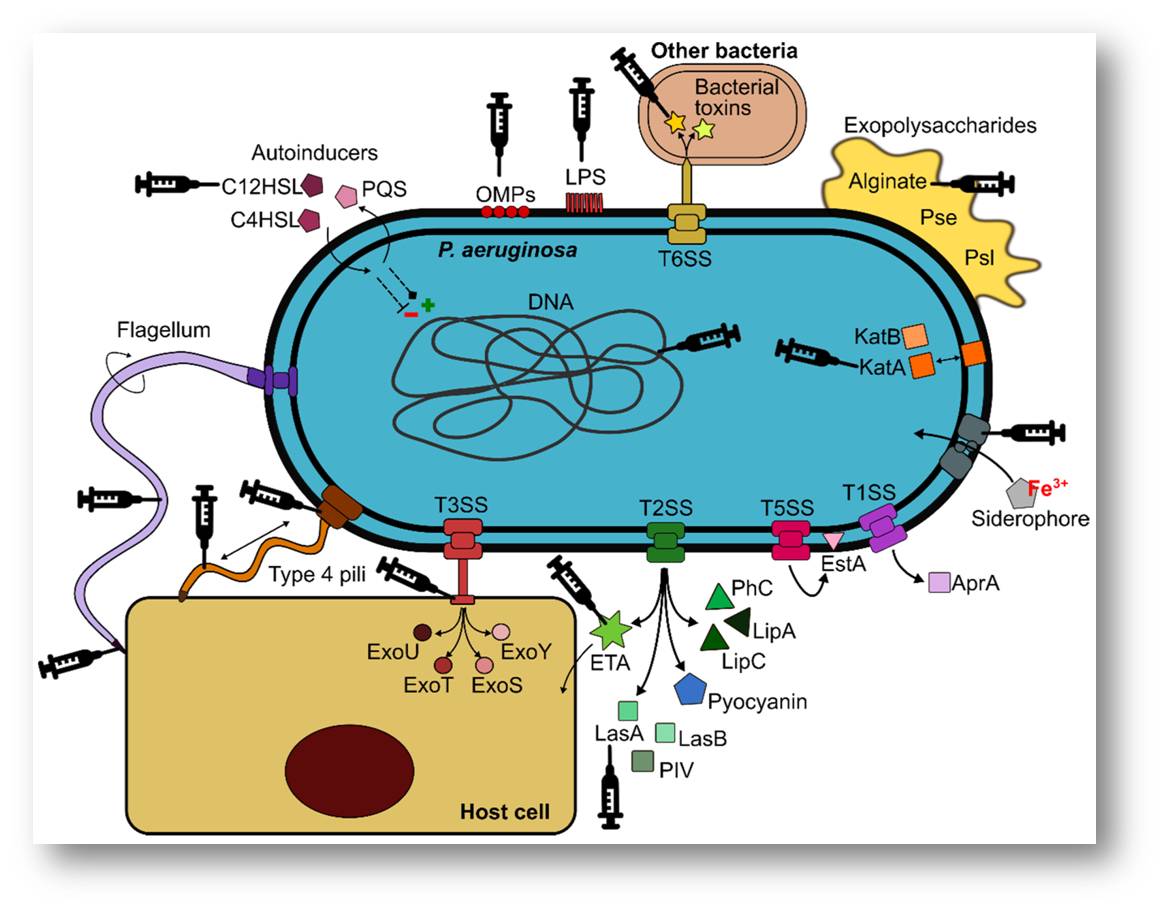
Jurado untersucht nun die Proteine, mit denen sich das Bakterium an Lungenzellen anheftet. Dies könnte entscheidende Komponenten für einen Impfstoff liefern - genauso wie das SARS-CoV-2-Spike-Protein in Covid-19-Impfstoffen ein Target für unser Immunsystem darstellt. Abbildung 3.
|
Abbildung 3.Pseudomonas aeruginosa besitzt ein großes Arsenal an Virulenz-Faktoren (hier nicht näher erläutert), die in die Pathogenese der Lungeninfektion involviert sind. Die mit Spritzen gekennzeichneten Komponenten wurden bereits als Vakzinen-Antigene evaluiert. (Quelle: Maite Sainz-Mejíaset al., Cells2020,9, 2617; doi:10.3390/cells9122617. Lizenz: cc-by) |
„Wir versuchen herauszufinden, welche Immunantworten erforderlich sind, um Menschen vor Infektionen zu schützen“, erklärt Dr. Siobhán McClean, Immunologin am University College Dublin, Irland, die BactiVax leitet. Die Proteine, mit denen Bakterien an unseren Zellen andocken, sind oft gute Ziele für Vakzinen. Beispielsweise verwendet der Keuchhusten-Impfstoff fünf verschiedene Proteine, mit denen sich die Bakterien an den Zellen in unserem Rachen anheften.
Leider ist Pseudomonas ein härterer Feind als das Covid-19-Virus, da das Bakterium Dutzende von Proteinen an seiner Oberfläche aufweist. Damit ist es weniger offensichtlich, was in einen Impfstoff Eingang finden sollte, als beim Pandemievirus, bei dem das Spike-Protein das Ziel der Wahl ist.
Die Forscher finden jedoch, dass ein Impfstoff den Aufwand lohnt. „Falls wir einen Impfstoff zur Prävention von Infektionen bekommen, ist diese unserer Meinung nach besser als ständig zu versuchen, (problematische Infektionen) mit Antibiotika zu behandeln“, sagt Dr. McClean. "Wir sind auf eine eiserne Reserve an Antibiotika angewiesen, und wenn diese aufgebraucht sind, stecken wir fest."
- Karin Moelling, 29.08.2019: Ein Comeback der Phagentherapie?
- Karin Moelling, 4.07.2019: Viren gegen multiresistente Bakterien. Teil 1: Was sind Phagen?
- WHO: https://www.who.int/news/item/29-04-2019-new-report-calls-for-urgent-action-to-avert-antimicrobial-resistance-crisis
- PhagoProd: GMP manufacturing & GLP diagnostic: Towards a personalised phage therapy against antimicrobial resistance. Project 01.11.2018 - 31.12.2021. https://cordis.europa.eu/project/id/811749
- BactiVax: anti-Bacterial Innovative Vaccine Training Network. Project 01.10.2019 - 30.09.2023.https://cordis.europa.eu/project/id/860325
* Dieser Artikel wurde ursprünglich am 28. Juni 2021 von Anthony King in Horizon, the EU Research and Innovation Magazineunter dem Titel "More bacteria are becoming resistant to antibiotics – here's how viruses and vaccines could help" publiziert. Der unter einer cc-by-Lizenz stehende Artikel wurde von der Redaktion möglichst wortgetreu aus dem Englischen übersetzt. Abbildung 2 und 3 plus Beschriftungen wurden von der Redaktion eingefügt.


Comments
Ein (wie immer)…
Ein (wie immer) zukunftsweisender, spannender und kluger Beitrag der Autorin Inge Schuster