Hermann Mark und die Kolloidchemie. Anwendung röntgenographischer Methoden
Hermann Mark und die Kolloidchemie. Anwendung röntgenographischer MethodenFr, 27.02.2015 - 10:26 — Redaktion
![]() Der in Wien geborene und aufgewachsene Hermann Mark (1895 – 1992) gehört zu den berühmtesten Chemikern, die Österreich hervorgebracht hat. Mark gilt als (einer) der Begründer der neuen Disziplin „Polymerwissenschaften“; auf ihn gehen grundlegende Arbeiten über Polymerisationsmechanismen, Molekülmassenbestimmung und Strukturaufklärung von Polymeren – vor allem mittels den damals noch in den Kinderschuhen steckenden „Röntgenographischen Methoden“ – zurück. Damit gehörte Mark auch zu den Pionieren der damals in Entstehung begriffenen Strukturchemie. Ausführliche Biographien zu Marks Leben und Wirken sind in [1 - 3] nachzulesen.
Der in Wien geborene und aufgewachsene Hermann Mark (1895 – 1992) gehört zu den berühmtesten Chemikern, die Österreich hervorgebracht hat. Mark gilt als (einer) der Begründer der neuen Disziplin „Polymerwissenschaften“; auf ihn gehen grundlegende Arbeiten über Polymerisationsmechanismen, Molekülmassenbestimmung und Strukturaufklärung von Polymeren – vor allem mittels den damals noch in den Kinderschuhen steckenden „Röntgenographischen Methoden“ – zurück. Damit gehörte Mark auch zu den Pionieren der damals in Entstehung begriffenen Strukturchemie. Ausführliche Biographien zu Marks Leben und Wirken sind in [1 - 3] nachzulesen.
1932 nach Wien auf den Lehrstuhl für Chemie berufen, leitete Mark bis 1938 das 1. Chemische Institut der Universität Wien. Er lehrte physikalische Chemie und betrieb Grundlagenforschung. Er führte die Röntgenstrukturanalyse ein, schuf (zusammen mit E. Guth) eine statistische Theorie der Elastizität von Gummi-artigen Molekülen und baute den weltweit ersten Studiengang für Polymerwissenschaften auf.
Mark war ein großartiger Redner und hat auch außerhalb der akademischen Welt populäre, leicht verständliche Vorträge gehalten. So beispielsweise am 21. Feber 1934 im Verein zur Verbreitung naturwissenschaftlicher Kenntnisse in Wien.
Im Folgenden findet sich dieser Vortrag [4] in einer für den Blog adaptierten, leicht gekürzten Form mit einigen zusätzlichen Untertiteln.
 Hermann Mark: Über die Bestimmung kleinster Teilchen mit Hilfe von Röntgenstrahlen [4]
Hermann Mark: Über die Bestimmung kleinster Teilchen mit Hilfe von Röntgenstrahlen [4]
Erst im letzten Jahrzehnt hat man in vollem Umfang die Bedeutung erkannt, die kleine, in einer Flüssigkeit suspendierte feste oder flüssige Teilchen für chemische und besonders für physiologische Prozesse haben können. Wenn man einen Festkörper — etwa Quarz, Glas, Kupfer, Kohle usw. — allmählich immer mehr zerkleinert, so erhält man einen immer feiner werdenden Sand, dessen Aufschwemmung im Wasser zunächst keine neuen fremdartigen Erscheinungen ergibt. Die in der Flüssigkeit aufgewirbelten Teilchen setzen sich mehr oder weniger rasch ab und es erfolgt von selbst eine Trennung der beiden Komponenten des betrachteten Systems.
Kolloide Lösungen…
Wenn man aber die Zerkleinerung der festen Phase sehr weit treibt, sodass Partikel von besonderer Feinheit entstehen, dann erhält die Suspension dieser Partikeln in Wasser neuartige, besonders interessante Eigenschaften. Die Teilchen bleiben nämlich dann beliebig lange in der Flüssigkeit schweben und bilden je nach der Konzentration entweder völlig klare oder schwach opalisierende Lösungen von großer Stabilität; eine freiwillige Entmischung erfolgt nicht mehr.
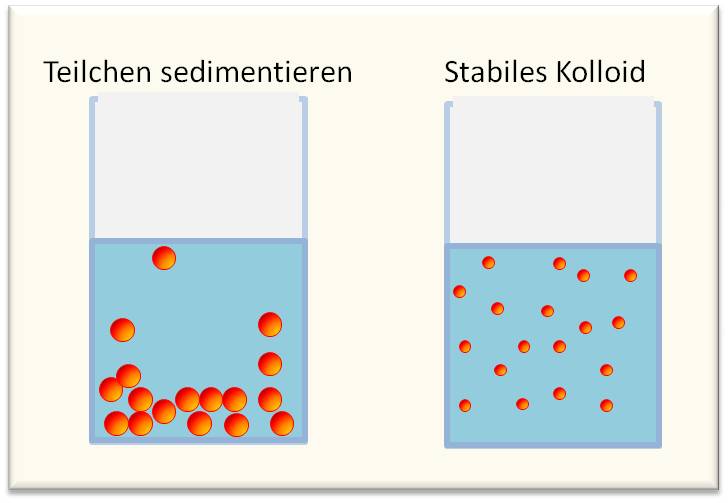 Im Wasser aufgeschwemmte Teilchen sedimentieren (links), bei sehr hohem Mahlgrad entstehen stabile kolloide Lösungen (rechts).
Im Wasser aufgeschwemmte Teilchen sedimentieren (links), bei sehr hohem Mahlgrad entstehen stabile kolloide Lösungen (rechts).
Während man sich in den vergangenen Jahrzehnten im wesentlichen dem Studium homogener Systeme und wahrer Lösungen zugewendet hatte, blieben die soeben geschilderten scheinbaren oder kolloiden Lösungen lange Zeit unbeachtet, und es war das Verdienst einer Reihe von Forschern, wie: Ostwald, McBain, Freundlich, Pauli u. a., das Augenmerk auf die Wichtigkeit dieser mikroheterogenen Systeme gelenkt zu haben.
Nachdem man einmal ihre Bedeutung erkannt hatte, fand man in der ganzen Chemie und besonders in biologischen Systemen immer wieder kolloide Lösungen — sogenannte Sole — der verschiedensten Zusammensetzung und Wirksamkeit.
…und ihre Herstellung…
Als einfachster Weg zur Herstellung kolloider Lösungen könnte die künstliche Zerkleinerung einer gegebenen Substanz durch geeignete Mahlvorrichtungen erscheinen. Wenn man aber versucht, diesen Weg praktisch zu beschreiten, dann findet man bald, daß der Mahlgrad, bis zu dem man vordringen kann, nicht ausreicht, um die für ein kolloides System charakteristischen Erscheinungen, besonders die Stabilität und Klarheit hervorzubringen. Die besten technischen Zerkleinerungsvorrichtungen, Kugelmühlen, Schlagkreuzmühlen usw., ermöglichen nämlich bei ihrer Anwendung auf feste anorganische oder organische Substanzen nur eine Zerkleinerung bis in die Gegend von 2—5 µm Durchmesser (1µm = 1/1000 mm). Diese Feinheit besitzen etwa feinstes Weizenmehl, Portlandzement und äußerst feine Farbstoffe. Wenn man Teilchen von dieser Größe in Wasser suspendiert, dann bleiben zwar diejenigen von ihnen lange schweben, deren spezifisches Gewicht nicht allzu sehr von dem des Wassers abweicht, wie Farbstoffe. Mehl, Stärke usw., die schwereren aber, Schwerspat, Zinkweiß usw., setzen sich nach kurzer Zeit praktisch vollständig ab.
…mit der Kolloidmühle…
Es ist also eine noch weitergehende Zerkleinerung nötig. Für diesen Zweck hat Hermann Plauson eine Schlagkreuzmühle konstruiert, deren rasch rotierende, sehr nahe aneinander vorbeistreichende Schlagkreuze in einer Flüssigkeit laufen. Durch die Anwesenheit dieser Flüssigkeit wird die Wirkung der Mühle außerordentlich gesteigert und man kann eine vorgegebene, bereits recht feine Suspension eines bestimmten festen Körpers bis auf Kolloidfeinheit herunter mahlen. Man hat diese sogenannte Kolloidmühle an sehr vielen Stoffen erprobt und brauchbar gefunden, allerdings kommt sie nur für die laboratoriumsmäßige Herstellung' von Solen in Frage, da sie für technische Zwecke zu unwirtschaftlich arbeitet. Es ist nämlich der Kraftaufwand für die in einer Flüssigkeit rasch rotierenden Schlagkreuzräder ein ungewöhnlich großer.
In der Praxis der Herstellung kolloider Lösungen musste man sich daher nach anderen Methoden umsehen und fand sie in den verschiedensten Möglichkeiten, Festkörper elektrisch zu zerstäuben oder zu versprühen.
…durch elektrische Zerstäubung…
So kann man z. B. nach Bredig die meisten Metalle dadurch in kolloide Verteilung bringen, daß man unter Wasser zwischen zwei metallischen Elektroden einen Lichtbogen brennen lässt. Durch die starke Erwärmung werden kleine Teilchen der Elektrode losgerissen und verteilen sich in der umgebenden Flüssigkeit als stabiles Metallsol, das bereits in jeder Richtung typisch kolloide Eigenschaften zeigt. Besonders beständig sind Sole aus edlen Metallen, wie Gold, Silber, Kupfer, Platin usw.; sie besitzen, abgesehen von ihrem wissenschaftlichen Interesse für die Kolloidchemie, auch eine gewisse praktische Bedeutung. Die außerordentlich feine Verteilung des Metalls bringt es nämlich mit sich, daß die spezifische Oberfläche der in der Lösung vorhandenen festen Phase außerordentlich groß ist, so daß alle auf Oberflächenwirkung beruhenden Effekte bei der Verwendung von kolloiden Systemen besonders in den Vordergrund treten. So bilden Platinsole ausgezeichnete Katalysatoren, die bei der Hydrierung organischer Substanzen allen anderen Beschleunigern erheblich überlegen sind, Silbersole werden als wirksame Desinfektionsmittel in der Heilkunde verwendet und wirken wahrscheinlich dadurch bakterizid, daß sie die Bakterien sowie die von ihnen erzeugten Giftstoffe an ihrer großen Oberfläche adsorbieren und hierdurch unwirksam machen.
Die eben erwähnten Metallsole zeigen je nach ihrer Herstellung verschiedene Farbe, ein Effekt, der in ihrer verschiedenen Teilchengröße seinen Grund findet und bei entsprechend genauer Bestimmung des Farbtones geradezu zur Messung der Teilchengröße verwendet werden kann.
…durch Ausfällung
Eine andere, vielleicht noch wichtigere Methode zur Herstellung kolloid verteilter Materie bildet die Fällung. So lassen sich Metallsulfide, Metalloxyde, Kieselsäure und andere anorganische Stoffe sehr leicht fein verteilt ausfällen und liefern Suspensionen von großer Stabilität, die alle typisch kolloiden Erscheinungen zeigen. Sogar nach dem Entfernen des Lösungsmittels verbleibt der Rückstand häufig in so feiner Verteilung, daß man Systeme von außerordentlich großer spezifischer Oberfläche erhält, die für technische Zwecke Verwendung finden; man nennt diese festen Systeme mit kolloiden Eigenschaften Gele. So dient Kieselsäuregel in verschieden fein verteiltem Zustand in der Technik als Absorptionsmittel für Gase und flüchtige Lösungsmittel. Zahlreiche andere aus anorganischen Solen hergestellte Gele, wie Aluminiumoxyd, Eisenoxyd usw., werden als Trägersubstanzen für Katalysatoren verwendet.
Diese kurze Einleitung über die Herstellung und Verwendung fester und flüssiger kolloider Systeme möge genügen, um die allgemeine Bedeutung dieses besonderen Zustandes der Materie zu kennzeichnen, nunmehr sei dazu übergegangen, die wichtigste Frage zu behandeln:
Die Bestimmung der Größe kolloider Teilchen…
Die direkte mikroskopische Vermessung kleiner Partikeln ist an die Wellenlänge des verwendbaren Lichtes geknüpft: eine direkte Abbildung im Mikroskop ist nur so lange möglich, als die Teilchen groß gegenüber der Wellenlänge des Lichtes sind. Wenn diese Bedingung nicht mehr zutrifft, dann treten Beugungserscheinungen auf, durch die die Abbildung verschwommen und ungenau wird, so daß von einer direkten Messung nicht mehr gesprochen werden kann. Das Gebiet des sichtbaren Lichtes endet bei einer Wellenlänge von etwa 400 Nanometer (= 4000 Ångström) dies ist also auch die Grenze der visuell noch direkt beobachtbaren Teilchengröße.
Man hat versucht, durch Verwendung ultravioletter Strahlen auf photographischem Wege den Anwendungsbereich des normalen Mikroskops zu erweitern und ist bis zur Wellenlänge von etwa 200 Nanometer gegangen. Dies bedeutet aber keine erhebliche Erweiterung des Anwendungsbereiches: Zudem ist das Verfahren wegen der Notwendigkeit einer Quarzoptik und photographischer Registrierung recht umständlich. Zusammenfassend kann man daher sagen, dass die normalen optischen Hilfsmittel unter günstigsten Bedingungen noch die Vermessung von Teilchen in der Größenordnung von 0,8 bis 1,2 µm gestatten, also an der oberen Grenze des für den kolloiden Zustand charakteristischen Gebietes enden.
…mit dem Ultramikroskop*
Dieses gestattet zwar nicht, ein Teilchen seiner Form und Größe nach direkt zu beobachten, ermöglicht aber die Zahl der in einem bestimmten, sehr kleinen Volumen befindlichen Teilchen anzugeben. Wenn man nun das Gewicht der im gesamten System verteilten festen Materie und auf ultramikroskopischem Wege auch die Zahl der insgesamt vorhandenen Teilchen zunächst durch Auszählung in einem kleinen Bereich und dann durch Multiplikation ermittelt hat, dann kann man das Gewicht des Einzelteilchens und bei Kenntnis der Dichte auch die Größe des Einzelteilchens angeben. Unter bestimmten Bedingungen lässt sich so in kolloiden Lösungen eine recht verlässliche Bestimmung der mittleren Teilchengröße durchführen. Festen Kolloiden gegenüber aber versagt diese Methode völlig und ebenso, wenn die suspendierten Teilchen in der Lösung schlecht sichtbar sind, wie das bei fast allen organischen Solen, besonders bei den physiologisch wichtigen Systemen, wie Eiweiß, Stärke usw., der Fall ist. Hier sind die gelösten Teilchen optisch nicht genügend gegen das Lösungsmittel differenziert und können daher in ihm nicht so deutlich wahrgenommen werden, daß sich eine sichere Zählung ermöglichen ließe.
…und der röntgenographischen Methode
Vor etwa 15 Jahren wurden Röntgenstrahlen auch zur Bestimmung der Teilchengröße kolloider Systeme herangezogen. Um diese Möglichkeit entsprechend klar zu machen, wird es notwendig sein, kurz auf die Wechselwirkung zwischen Röntgenstrahlen und Kristallen einzugehen.
Die Wellenlänge der Röntgenstrahlen (um 1 Ångström) ist etwa tausendmal kleiner als die des normalen Lichtes. Die Atomabstände in den festen und flüssigen Körpern fallen in dieselbe Größenordnung. Insbesondere bei kristallisierten Festkörpern bewirkt die regelmäßige Anordnung der einzelnen Atome, daß der Kristall den Röntgenstrahlen gegenüber sich verhält wie ein völlig geordnetes Raumgitter, an dem eine regelrechte Beugung der Wellenstrahlung stattfinden kann, ganz ebenso wie Licht an Gittern, deren Maschenweite mit der Wellenlänge vergleichbar ist, deutliche Beugungserscheinungen liefert. Die Interferenz oder Beugung der Röntgenstrahlen an Kristallgittern, die im Jahre 1912 erstmals von M. v. Laue verwirklicht wurde, liefert charakteristische Diagramme, wobei punktförmige Schwärzungen regelmäßig, aber mit verschiedenen Intensitäten auftreten. Solche Diagramme sind heute das sicherste Mittel, um festzustellen, ob sich ein bestimmter Stoff im kristallisierten oder amorphen Zustand befindet. Während kristallisierte Substanzen wohldefinierte intensive Diagramme mit scharfen Interferenzpunkten liefern, ergeben Flüssigkeiten nur verwaschene, undeutliche Beugungsbilder in Form eines breiten Ringes.
Der Unterschied ist leicht zu verstehen. Im Kristallgitter sind die einzelnen Beugungszentren wohlgeordnet und die Gangunterschiede der an ihnen gestreuten Röntgenstrahlen gehorchen scharfen Gesetzen. Diese Regelmäßigkeit führt dazu, daß sich in bestimmten Richtungen sehr viel Intensität anhäuft, während in anderen durch Interferenz eine so gut wie völlige Auslöschung eintritt; daher beobachtet man intensive Interferenzpunkte neben strahlungsfreien Bereichen.
In einer Flüssigkeit ist durch die unausgesetzte Bewegung der einzelnen Teilchen die Regelmäßigkeit viel weniger ausgeprägt. Daher verschwimmen hier die Gangunterschiede der an den einzelnen Molekülen gestreuten Wellen und mit ihnen die Interferenzfiguren der Diagramme.
Aus der Lage und Intensität der Beugungspunkte eines Kristallgitterdiagramms lassen sich wichtige Schlüsse über die Struktur der Kristalle, über die Größe und Form und sogar über die innere Struktur der Atome ziehen. Hier soll nur davon die Rede sein, wie man die Größe der einzelnen Kriställchen aus einem Röntgenogramm bestimmen kann. Man braucht dazu nur auf den oben betonten Unterschied zwischen Einkristalldiagramm und Flüssigkeitsbildern etwas näher einzugehen: die scharfen, intensiven Reflexe der Kristallbilder, die beim Übergang zum Flüssigkeitsbild zu verwaschenen Streifen verschwimmen.
Wenn man nun ein aus sehr kleinen Kriställchen bestehendes Pulver als Zwischending zwischen Einkristall und Flüssigkeit auffasst, ein Standpunkt, der zumindest qualitativ berechtigt ist, dann wird man zu erwarten haben, daß sehr feinkristalline Pulver Diagramme geben, die nicht mehr so scharf sind, wie die von groben Kristallen herrührenden und noch nicht so verwaschen wie Flüssigkeitsdiagramme, und wird mit abnehmender Korngröße eine zunehmende Verwaschung der Interferenzen erwarten.
In der Tat konnten u.a. P. Scherrer und später ausführlicher M. v. Laue zeigen, dass die Größe der beugenden Teilchen mit der Schärfe der an ihnen entstehenden Interferenzerscheinungen verknüpft ist (Scherrer-Lauesche Gleichung). Da die Wellenlänge der Röntgenstrahlen in der Größenordnung von Ångström liegt, kann man auf diesem Wege auch noch die Dimensionen besonders kleiner Teilchen bestimmen. Die Methode ist gerade im kolloiden Gebiet besonders bedeutsam. Sie besitzt den Vorteil, sowohl auf Suspensionen als auch auf feste Körper angewendet werden zu können, und setzt nur voraus, daß die zu vermessenden Teilchen kristallinen Charakter haben.
Dazu einige besonders interessante Ergebnisse
Wie man seit den grundlegenden Versuchen von R. 0. Herzog und Scherrer aus dem Jahre 1920 weiß, sind nicht nur die anorganischen Kolloide, sondern auch die meisten organischen, biologischen und physiologischen Objekte, wie Fasern, Muskel, Haare usw., kristallin und fallen daher in den Anwendungsbereich der röntgenographischen Teilchengrößenbestimmung. Die erste praktische Durchführung dieser Methode erfolgte durch Scherrer selbst, der an verschiedenen Goldsolen die Größe der suspendierten Teilchen einerseits durch Auszählen, andererseits röntgenographisch bestimmte und sehr gute Übereinstimmung in den Ergebnissen fand. Später hat eine große Reihe von Forschern sich ihrer zur Teilchengrößenbestimmung im submikroskopischen Gebiet bedient.
Die Struktur von Ruß
Ein sehr häufig untersuchtes Objekt bildet der Kohlenstoff in seinen verschiedenen Modifikationen - dem kubischen Diamant und dem hexagonalen Graphit. Daneben gibt es den Ruß in den verschiedensten Arten und Eigenschaften, eine Substanz, die man bisher stets als amorphen Kohlenstoff angesprochen hat. Röntgenographische Untersuchungen zahlreicher Rußsorten haben aber in fast allen Fällen Interferenzbilder gezeigt, aus denen man auf das Vorliegen der Graphitstruktur zu schließen hat. Allerdings sind die Diagramme vieler Rußsorten sehr verwaschen und geben von der außerordentlichen Kleinheit der Graphitteilchen Kunde.
Je nach der Herstellung des Rußes aus Paraffin oder Leuchtgas erhält man Rußsorten von außerordentlich verschiedener Teilchengröße, deren technische Eigenschaften ebenfalls stark voneinander abweichen und in charakteristischer Weise mit der Korngröße zusammenzuhängen scheinen. Ebenso wie der Graphit blättchenförmige Struktur besitzt, ergibt sich, daß die Rußteilchen nicht in allen Dimensionen gleich groß sind, sondern äußerst dünne Blättchen darstellen, deren Achsenverhältnis man aus röntgenographischen Untersuchungen ableiten kann.
Der als Druckerschwärze verwendete Öl-oder Lampenruß besitzt Teilchengrößen zwischen 100 und 200 Ångström, während der in der Gummiindustrie in größtem Umfang verwendete Gasruß seine besten technischen Eigenschaften entfaltet, wenn die Teilchen zwischen 50 und 100 Ångström mittlere Kantenlänge aufweisen. Diese außerordentlich feinen Kohlenstoffkriställchen verfestigen eine Kautschukmischung, mit der sie innig vermengt werden, etwa auf das 3- bis 4fache ihrer ursprünglichen Widerstandsfähigkeit.
Man darf annehmen, daß durch die Vulkanisation die Rußteilchen mit den langen kettenförmigen Molekülen des Kautschuks chemisch verknüpft werden, so daß eine außerordentlich feste Verbindung zwischen den einzelnen Komponenten der Mischung entsteht. Daß die wirksamsten Kautschukruße außerordentlich kleine Teilchen haben, geht auch daraus hervor, daß sie nicht mehr rein schwarz, sondern eher braun- oder blaustichig erscheinen.
Noch feiner verteilten Kohlenstoff erhält man bei der Zersetzung des Kohlensuboxydes, eines merkwürdigen interessanten Gases, dem die Formel C3 O2 zukommt und das nach Klemenc bei seiner Erhitzung ein rotes Pulver liefert, dessen röntgenographische Untersuchung Graphitstruktur mit außerordentlich geringer Teilchengröße ergab. Die mittlere Ausdehnung der Körner beträgt hier nur etwa 30 Ångström; ein Kristall dieser Substanz enthält daher nur etwa 1000 Kohlenstoffatome und wiegt nicht mehr als 2.10-20 g. Er verhält sich dem Gewicht nach zu einem Zentner etwa so wie 1 Zentner zum Gewicht der ganzen Erde.
Eine andere interessante und auch technisch wichtige Modifikation der Kohle ist in den aus organischen Substanzen — Knochen, Holz, Blut usw. — hergestellten Präparaten zu finden, die eine besonders starke Aufnahmefähigkeit für Gase und Dämpfe zeigen. Man hat diese Eigenschaft schon seit langem mit der großen inneren Oberfläche solcher Absorptionskohlen in Verbindung gebracht, die man sich als äußerst feinporigen Schwamm vorzustellen hat, in dem das zu adsorbierende Gas aufgesaugt wird. Die röntgenographische Untersuchung zeigt auch hier das Vorliegen des Graphitgitters und ergab außerordentlich kleine Dimensionen für die kristallisierten Bereiche.
…von Kieselsäuregelen…
Ein ähnliches Ergebnis liefert die Untersuchung von Kieselsäuregelen, die ebenso wie die erwähnten Kohlen in der Technik für die Wiedergewinnung von Lösungsmitteln, bzw. für das Festhalten von Gasen in Filtern, Gasmasken- usw. gebraucht werden. Auch von diesen Stoffen erhält man Röntgenogramme, aus denen neben der kristallinen Natur die außerordentliche Kleinheit der Kristallenen hervorgeht.
…und technischen Katalysatoren
Besonders interessante Ergebnisse hat die Bestimmung der Teilchengröße bei der Untersuchung technischer Katalysatoren zutage gefördert. Unter einem Katalysator versteht man einen Stoff, der durch seine bloße Anwesenheit den Ablauf einer chemischen Reaktion zu beschleunigen vermag, ohne hiebei merklich verändert zu werden. Die Erfahrung hat gelehrt, daß die Wirkung der Katalysatoren an eine Fixierung der Reaktion an die Oberfläche gebunden ist und daß diese Stoffe um so wirksamer sind, je größer die spezifische Oberfläche der verwendeten Präparate gemacht werden kann. Hier hat die röntgenographische Untersuchung eingegriffen und gezeigt, daß die Wirksamkeit von Kontakten in der Tat mit abnehmender Teilchengröße beträchtlich zunimmt.
Um einen über längere Zeit aktiven Kontakt zu erhalten, ist es aber notwendig, dafür zu sorgen, daß die feine Verteilung der Substanz nicht während der Reaktion allmählich verlorengeht. Da die meisten chemischen Reaktionen bei höherer Temperatur durchgeführt werden, ist die Gefahr einer Rekristallisation und Sinterung der Kontakte sehr häufig akut und man muss besondere Maßnahmen treffen, um sie zu verhindern. Als sehr wirksam hat sich in dieser Hinsicht das Beimischen geringer Mengen von Stabilisatoren erwiesen, durch die ein Zusammenkristallisieren der einzelnen äußerst feinen Körner des Katalysators verhütet wird.
Fazit
Die wenigen geschilderten Beispiele mögen zeigen, wie vielseitig die röntgenographische Methode in ihrer Anwendung auf wissenschaftliche und technische Fragen ist. Überall dort, wo man sich für die Größe und Form von Kriställchen interessiert, die in Gebieten zwischen 10 und 500 Ä liegen, wird man in dieser Methode ein verlässlich und bequem arbeitendes Hilfsmittel finden.
[1] Herbert Morawetz: Hermann Francis Mark – a biographical Memoir (1995) National Academy Press (Washington) http://www.nasonline.org/publications/biographical-memoirs/memoir-pdfs/m...
[2] Johannes Feichtinger. Herman F. Mark (1895–1992): Viennese Born ‘Ambassador’ of Macromolecular Research (6th Int. Conf. History of Chemistry) http://www.academia.edu/371220/Herman_F._Mark_1895-1992_Viennese_Born_Am...
[3] Herman Mark and the Polymer Research Institute http://www.acs.org/content/acs/en/education/whatischemistry/landmarks/po...
[4] Hermann Mark: in Jahrbuch 74 (1934) des Vereins zur Verbreitung naturwissenschaftlicher Kenntnisse, Wien: http://www.landesmuseum.at/pdf_frei_remote/SVVNWK_74_0041-0059.pdf