Wunderwelt der Kristalle — Die Kristallographie feiert ihren 100. Geburtstag
Wunderwelt der Kristalle — Die Kristallographie feiert ihren 100. Geburtstag
Fr, 20.03.2014 - 20:12 — Bernhard Rupp
![]()
 Vor hundert Jahren erfolgte die Verleihung des Nobelpreises an Max von Laue für seine Entdeckung der Beugung von Röntgenstrahlen an Kristallgittern. Dies war die Geburtsstunde der Kristallographie, die es seitdem ermöglicht fundamentale Erkenntnisse zu Struktur und Funktion von kleinen und großen Molekülen zu gewinnen..
Vor hundert Jahren erfolgte die Verleihung des Nobelpreises an Max von Laue für seine Entdeckung der Beugung von Röntgenstrahlen an Kristallgittern. Dies war die Geburtsstunde der Kristallographie, die es seitdem ermöglicht fundamentale Erkenntnisse zu Struktur und Funktion von kleinen und großen Molekülen zu gewinnen..
In einer feierlichen Zeremonie in ihrem Hauptquartier hat die UNESCO das Jahr 2014 zum Jahr der Kristallographie (IYCr) ausgerufen [1]. An Bedeutung steht die Kristallographie damit in einer Reihe mit anderen, von der UNO als global wichtig erachteten Themen, wie es beispielsweise Biodiversität, erneuerbare Energie oder Wasserversorgung sind.
Warum erscheint der UNO dieses Gebiet so bedeutend, von dem nur wenige unserer Zeitgenossen bis jetzt überhaupt gehört haben?
Die Struktur von Materialien bestimmt deren Eigenschaften und Funktion
Dieser Satz trifft für alle Materialien zu. Die Eigenschaften von Gasen, Flüssigkeiten, Gesteinen, Mineralien, Halbleitern oder Medikamenten werden ebenso durch ihre molekulare Struktur bestimmt, wie die Funktion von Proteinen und deren hochmolekularen Komplexen, den eigentlichen „Maschinen des Lebens“. Der Nobelpreisträger und Mitentdecker der DNA-Struktur, Francis Crick, hat dies prägnant formuliert:
„Praktisch alle Aspekte des Lebens basieren auf dem Aufbau aus Molekülen, ohne ein Verständnis der Moleküle, können wir das Leben selbst nur in groben Umrissen verstehen“.
Was ist Kristallographie?
Kristallographie ist die Wissenschaft, die es uns erlaubt den Aufbau von Stoffen in detailliertester Weise auf ihrer atomaren und molekularen Ebene zu untersuchen. Alle kristallographischen Techniken beruhen – wie der Name schon sagt - auf der Untersuchung von Kristallen. Liegen Atome oder auch komplexe Moleküle in derart geordneten Strukturen vor, so werden an den regelmäßig angeordneten Atomen Röntgenstrahlen, Neutronen oder auch Elektronen gebeugt. Aus den entstehenden Beugungsmustern lässt sich dann die dreidimensionale Struktur eines Moleküls präzise, bis in atomare Details rekonstruieren.
Dies klingt im Prinzip recht einfach, aber zur Aufnahme der Beugungsmuster werden oft sehr ausgeklügelte Maschinen, wie zum Beispiel Synchrotron-Strahlenquellen oder starke Neutronenquellen benötigt. Die Rekonstruktion komplexer atomarer Modelle aus den Beugungsdaten kann ebenfalls äußerst aufwendig sein. Kristallographie ist also kein einfaches bildgebendes Verfahren (Imaging) wie dies heute in der Mikroskopie angewandt wird. Dazu kommt die primäre Voraussetzung für die Kristallographie, daß eine Substanz von vornherein als Kristall vorliegen oder sich im Labor kristallisieren lassen muß.
Nichtsdestoweniger liegen bis jetzt hunderttausende Strukturen kleiner anorganischer und organischer Verbindungen bis hin zu großen Biomolekülen in Datenbanken gespeichert vor. Der überwiegende Teil (rund 90 %) dieser Strukturen wurde durch Röntgenkristallographie ermittelt, deren Prinzip in Abbildung 1 schematisch dargestellt ist.
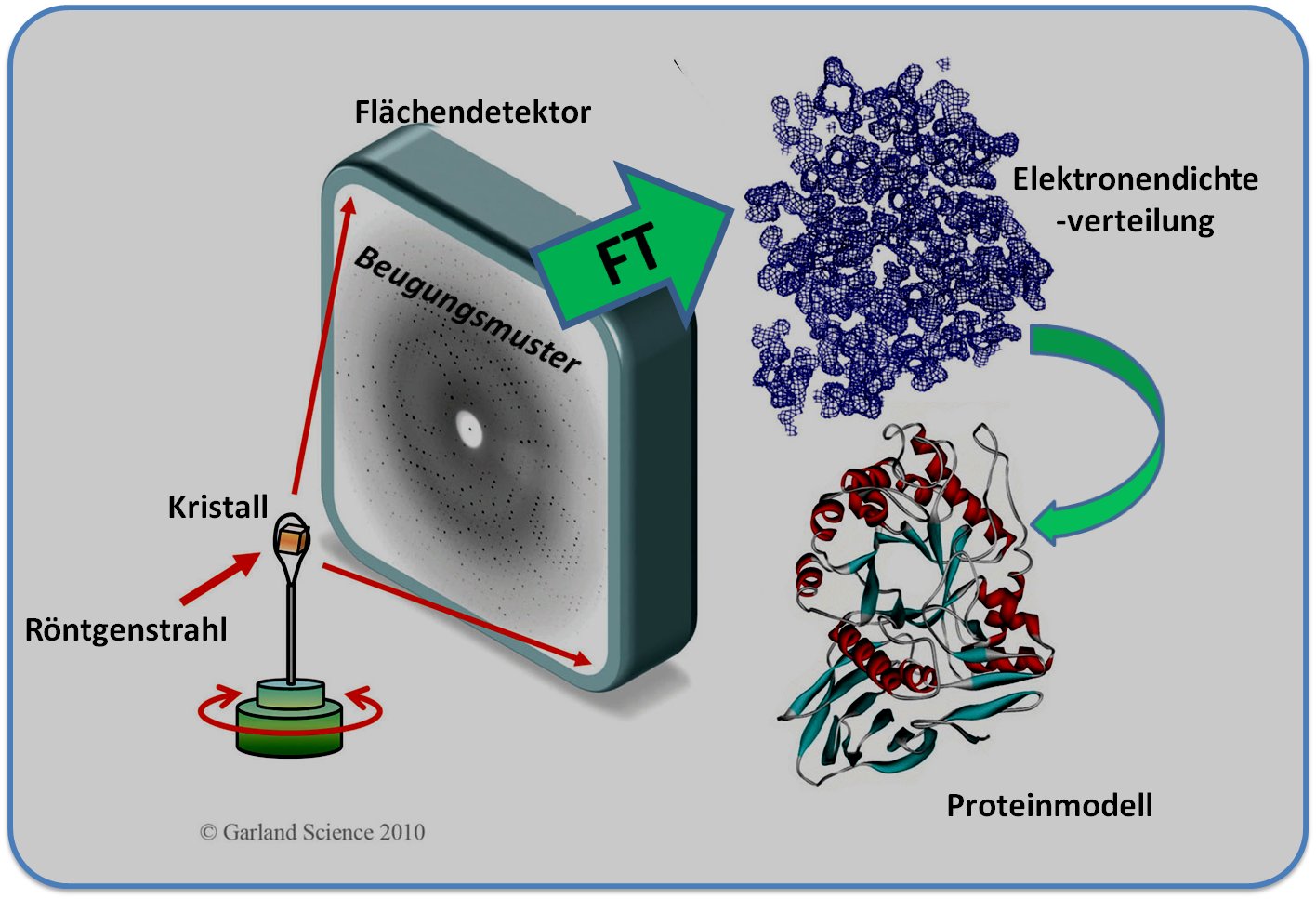 Abbildung 1, Prinzip der Röntgenkristallographie. Ein Kristall, der hier aus geordneten Proteinmolekülen besteht, ist auf einer Vorrichtung (Goniostat) montiert, welche die Drehung um zumindest eine Achse ermöglicht. Der Kristall wird fein-gebündelten (kollimierten), intensiven Röntgenstrahlen ausgesetzt, welche an den Elektronenhüllen der Atome gebeugt werden. Die resultierenden Beugungsbilder werden auf einem Flächendetektor aufgenommen und zu einem Set von Beugungsdaten zusammengesetzt – einem reziproken Code für die räumliche Anordnung der Atome im Kristall. Die Übersetzung diese Codes mittels mathematischer Methoden (Fourier-Transformation: FT) und Kenntnis der zugehörigen Phasenwinkel erlaubt es die Elektronendichte für die streuenden Atome zu rekonstruieren und aus diesen ein dreidimensionales Modell der Struktur zu erzeugen - hier dargestellt in Form eines Ribbon (Bänder)-Modells.
Abbildung 1, Prinzip der Röntgenkristallographie. Ein Kristall, der hier aus geordneten Proteinmolekülen besteht, ist auf einer Vorrichtung (Goniostat) montiert, welche die Drehung um zumindest eine Achse ermöglicht. Der Kristall wird fein-gebündelten (kollimierten), intensiven Röntgenstrahlen ausgesetzt, welche an den Elektronenhüllen der Atome gebeugt werden. Die resultierenden Beugungsbilder werden auf einem Flächendetektor aufgenommen und zu einem Set von Beugungsdaten zusammengesetzt – einem reziproken Code für die räumliche Anordnung der Atome im Kristall. Die Übersetzung diese Codes mittels mathematischer Methoden (Fourier-Transformation: FT) und Kenntnis der zugehörigen Phasenwinkel erlaubt es die Elektronendichte für die streuenden Atome zu rekonstruieren und aus diesen ein dreidimensionales Modell der Struktur zu erzeugen - hier dargestellt in Form eines Ribbon (Bänder)-Modells.
Die Geburtsstunde der Röntgenkristallographie
Der Physiker Max von Laue, seit 1909 Privatdozent an der Ludwig-Maximilian Universität in München, kam hier einerseits mit der Raumgitterhypothese des Kristallaufbaus in Berührung und andererseits mit der Theorie der Röntgenstrahlung. Wilhelm Conrad Röntgen, der 1885 die nach ihm benannte Strahlung entdeckt hatte (und dafür 1901 mit dem ersten Nobelpreis in Physik ausgezeichnet wurde), war Professor in München, ebenso der theoretische Physiker Arnold Sommerfeld, der von der Wellennatur dieser Strahlung überzeugt war. Wäre die Wellenlänge dieser Strahlung, so schloss Laue, in derselben Größenordnung, wie die Abstände der Atome im Kristallgitter, müsste ihr Durchgang durch den Kristall Beugungsmuster hervorrufen. Zusammen mit Walter Friedrich und Paul Knipping konnte Laue im Jahr 1912 seine Raumgitterhypothese erhärten (Abbildung 2).
Laue‘s Experiment bestätigte damit beides:
- die Wellennatur der Röntgenstrahlung
- den Aufbau der Materie aus diskreten Atomen.
Für seine Entdeckung der Röntgenstrahlbeugung an Kristallen wurde Laue im Jahr 1914 mit dem Nobelpreis ausgezeichnet.
 Abbildung 2. Zinkblende Beugungsmuster (Laue, Friedrich & Knipping, Sitz.ber. Bayer. Akademie d. Wiss. 8. Juni 1912) „Aber als nun jene Figur 5 sichtbar wurde, das erste typische LAUE-Diagramm, welches die Strahlung durch einen genau zur Richtung der Primärstrahlung orientierten Kristall regulärer Zinkblende wiedergab mit ihren regelmäßig und sauber in verschiedenen Abständen vom Zentrum angeordneten Interferenzpunkten, da ging ein allgemeines "ah" durch die Versammlung. Ein jeder von uns fühlte, daß hier eine große Tat vollbracht war“ (Zitat: Max Planck, 1937)
Abbildung 2. Zinkblende Beugungsmuster (Laue, Friedrich & Knipping, Sitz.ber. Bayer. Akademie d. Wiss. 8. Juni 1912) „Aber als nun jene Figur 5 sichtbar wurde, das erste typische LAUE-Diagramm, welches die Strahlung durch einen genau zur Richtung der Primärstrahlung orientierten Kristall regulärer Zinkblende wiedergab mit ihren regelmäßig und sauber in verschiedenen Abständen vom Zentrum angeordneten Interferenzpunkten, da ging ein allgemeines "ah" durch die Versammlung. Ein jeder von uns fühlte, daß hier eine große Tat vollbracht war“ (Zitat: Max Planck, 1937)
Der englische Physiker Sir William H. Bragg hatte eben von den ersten Versuchen zur Erstellung medizinischer Röntgendurchleuchtungsbildern erfahren, als sein fünfjähriger Sohn William sich den Arm brach und Bragg diese brandneue Technik benutzte um den Bruch zu untersuchen. Vater und Sohn blieben seitdem der Röntgenstrahlung verfallen. Der Vater baute das erste Röntgenstrahl-Spektrometer, das monochromatische Röntgenstrahlen verwendete (Strahlen mit einer einzigen Wellenlänge) und die Interpretation der Beugungsmuster enorm vereinfachte. Von höchster Bedeutung war der Ansatz des Sohnes die Beugung der Röntgenstrahlen als Reflexion an den Ebenen des Kristallgitters zu interpretieren: die berühmte Bragg-Gleichung, die den Beugungswinkel mit dem Abstand der Gitterebenen in Beziehung setzt, ist eine der Grundvoraussetzungen, um die Atompositionen innerhalb eines Kristalls genau zu bestimmen und damit seine dreidimensionale Struktur zu entschlüsseln. Vater und Sohn Bragg erhielten 1915 den Nobelpreis in Physik (mit 25 Jahren war der Sohn bis dato der jüngste Nobelpreisträger).
Aussagen über Materialeigenschaften: Warum ist der Diamant so hart?
Die ersten Beugungsmuster von Röntgenstrahlen wurden an Kristallen erhalten, die aus einem einzigen oder nur wenigen unterschiedliche Elementen bestanden, wie beispielsweise der Diamant (C), das Steinsalz (NaCl) oder die Zinkblende (Zinksulfid).
Der Diamant ist ein sehr harter Kristall, der unter hohem Druck und Temperatur aus reinem Kohlenstoff entstanden ist. Aus der Kristallstruktur des Diamanten wird ersichtlich warum dieser so hart ist im Gegensatz zu Graphit, einer anderen kristallinen Form des Kohlenstoffs, der u.a. als Bleistiftmine und Gleitmittel Verwendung findet (Abbildung 3):
Im Diamanten liegt jedes Kohlenstoffatom kovalent an vier weitere Kohlenstoffatome (in Tetraeder-Anordnung) gebunden vor. Die starken Kohlenstoff-Kohlenstoff Bindungen verbinden all Atome im Kristall und bewirken so dessen Härte. Im Graphit sind hexagonale Schichten kovalent gebundener Kohlenstoffatome übereinanderliegend angeordnet. Innerhalb einer Schicht sind die kovalenten Kohlenstoff-Kohlenstoff Bindungen ebenfalls sehr fest, die erheblich schwächeren nicht-kovalenten Wechselwirkungen zwischen den Schichten machen diese aber leicht gegeneinander verschiebbar: das Mineral ist in einer Ebene weicher und damit für eine Verwendung als Gleit-oder Schreibmittel geeignet.
 Abbildung 3. Kohlenstoff kann in vielen Kristallstrukturen vorliegen – als extrem harter Diamant, als weicher Graphit, als sphärische Fullerene, zu denen Kohlenstoff-Nanotubes und Buckyballs (hier die an einen Fußball erinnernde, aus 60 C-Atomen bestehende Form) gehören.
Abbildung 3. Kohlenstoff kann in vielen Kristallstrukturen vorliegen – als extrem harter Diamant, als weicher Graphit, als sphärische Fullerene, zu denen Kohlenstoff-Nanotubes und Buckyballs (hier die an einen Fußball erinnernde, aus 60 C-Atomen bestehende Form) gehören.
Reiner Kohlenstoff kann auch hochkomplexe Strukturen bilden wie beispielsweise die Fullerene – aus 5-er und 6-er Kohlenstoffringen zusammengesetzte, gewölbte Strukturen. Dazu gehören Nanotubes – meist wenige Nanometer dünne und bis zu Zentimeter lange Röhrchen mit einem enormen Potential an technischen Anwendungsmöglichkeiten. Dazu gehören auch die sphärischen Buckyballs, wie die natürlich vorkommende, aus 60 Kohlenstoffatomen bestehende Form (Buckminsterfulleren), die an einen Fußball erinnert. Auch die Struktur dieser Buckyballs wurder mittels Röntgenkristallographie aufgeklärt.
100 Jahre Kristallographie
Seit den Entdeckungen von von Laue und den Braggs hat die Kristallographie zu enormen Durchbrüchen im Verständnis der physikalischen und chemischen Eigenschaften von Materialien geführt, ebenso wie zu fundamentalen Einblicken in die Struktur und Funktion großer biologischer Moleküle. Für bahnbrechende Fortschritte in kristallographischen Techniken und daraus resultierenden Ergebnissen wurden bis jetzt 29 Nobelpreise verliehen [2].
Weit mehr als 100 000 Kristallstrukturen von Mineralien, anorganischen und synthetischen organischen Verbindungen sind in der “Crystallography Open Database" (COD) [3] gespeichert, derzeit werden es jährlich um rund 20 000 Strukturen mehr (Abbildung 4). Rund 100 000 Strukturmodelle von Proteinen aus Tieren, Pflanzen und Mikroorganismen sind in der frei zugänglichen Protein Datenbank (PDB) [ 4 ] abrufbar und – bei steigender Tendenz - kommen rund 10 000 neue Strukturen jährlich dazu (Abbildung 4).
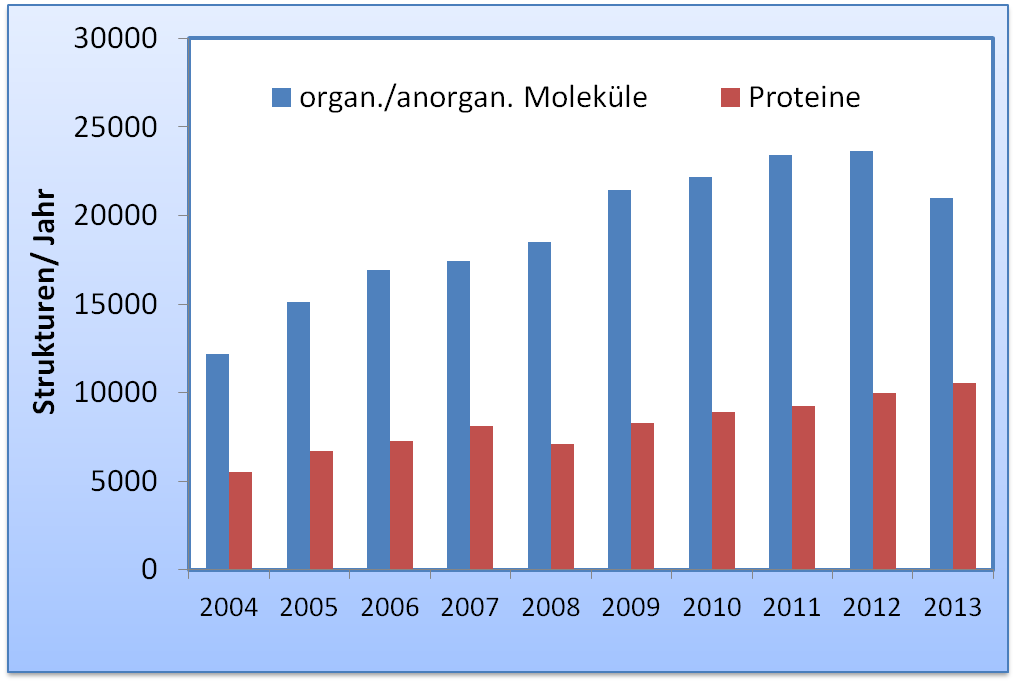 Abbildung 4. Der jährliche Zuwachs an neuen Strukturen ist im letzten Jahrzehnt stark gestiegen. Daten von kleinen organischen und anorganischen Verbindungen sind der Crystallography Open Database (COD) entnommen [3], Daten zu Proteinstrukturen stammen aus der Protein Data Bank (PDB) [4].
Abbildung 4. Der jährliche Zuwachs an neuen Strukturen ist im letzten Jahrzehnt stark gestiegen. Daten von kleinen organischen und anorganischen Verbindungen sind der Crystallography Open Database (COD) entnommen [3], Daten zu Proteinstrukturen stammen aus der Protein Data Bank (PDB) [4].
Die kristallographischen Ergebnisse haben einen Quantensprung in den Möglichkeiten herbeigeführt, hochqualitative Materialien – wie wir sie heute täglich verwenden - zu entwerfen und herzustellen. Eine ähnliche Revolution hat die Kristallographie in unserem Verständnis von biologischer Struktur und Funktion bewirkt. Seit in den frühen 1950er Jahren die erste Strukturaufklärung eines Proteins – des Myoglobins – glückte, ist eine riesige Anzahl von Strukturen auch sehr großer Proteine und noch viel größerer Protein-Komplexe aufgeklärt worden. Die genaue Kenntnis derartiger Strukturen dient nicht nur zum prinzipiellen Verständnis des Aufbaus biologischer Moleküle und der daraus abgeleiteten biologischen Funktion, sondern erlaubt es auch passgenau Modulatoren für bestimmte Funktionen zu entwerfen. Dies hat besondere Bedeutung für das Design von neuen hochwirksamen Arzneimitteln. Auf Grund der Wichtigkeit dieses Themenkreises erfolgt eine Darstellung der Kristallographie von großen Biomolekülen in einem nachfolgenden, separaten Artikel.
[1] Ban Ki-moon, UN Secretary-General , Video 2:12 min. https://www.youtube.com/watch?list=UU5O114-PQNYkurlTg6hekZw&v=RN8jGTJQ3fU
[2] http://www.iucr.org/people/nobel-prize
[3] Crystallography Open Database (COD) http://www.crystallography.net
[4] Protein Data Bank http://www.wwpdb.org/stats.html
Weiterführende Links
Homepage von Bernhard Rupp: http://www.ruppweb.org/iycr/IYCr_2014.htm
Bernhard Rupp: Biomolecular Crystallography: Principles, Practice, and Application to Structural Biology (2009): das umfassende Lehrbuch über Grundlagen, Techniken und Anwendungen der Kristallographie. http://www.ruppweb.org/garland/default.htm
Internationales Jahr der Kristallographie: http://www.iycr2014.de /
Video: Introduction to X-ray crystallography 17.26 min (harvardbmw’s videos; in Englisch)) http://vimeo.com/7643687
Video: Celebrating Crystallography 3:05 min. (Englisch) http://www.richannel.org/celebrating-crystallography
Max Perutz: X-ray analysis of haemoglobin, Nobel Lecture, December 11, 1962; http://research.chem.psu.edu/sasgroup/chem540/downloads/perutz-lecture.pdf