Ein Dach mit 36 Löchern abdichten - vorsichtiger Optimismus in der Alzheimertherapie.
Ein Dach mit 36 Löchern abdichten - vorsichtiger Optimismus in der Alzheimertherapie.Fr, 24.06.2016 - 06:03 — Inge Schuster
Vor wenigen Tagen ist in der Fachzeitschrift "Aging" ein Artikel erschienen, der einen neuen Therapieansatz für die Alzheimer-Krankheit beschreibt, mit dem bei einem (allerdings) kleinen Patientenkollektiv ein noch nie dagewesener Erfolg erzielt wurde [1]. Der Ansatz beruht auf den Forschungsergebnissen von Dale Bredesen, einem international renommierten Experten auf dem Gebiet der Mechanismen neurodegenerativer Erkrankungen. Er strebt dabei eine Optimierung der Signale von Nervenzellen an, die hinsichtlich Bildung und Abbau von Synapsen in ein Ungleichgewicht geraten sind.
Erfreulicherweise werden wir immer älter. Aktuell haben in der Eurozone Knaben bei Geburt bereits eine Lebenserwartung von 79,2 Jahren und Mädchen von 84,7 Jahren [2]. In allen Regionen der Welt sinkt die Mortalitätsrate der 60+ Bevölkerung, die Lebenserwartung steigt. Österreich betreffend zählt die Statistik Austria 2016 rund 770 000 Personen, die 75 Jahre und älter sind - dies sind schon um etwa 100 000 mehr als es 2010 gewesen sind; dabei gibt es 1290 Personen, die mindestens 100 Jahre alt sind [3].
Demenz-Erkrankungen
Die Kehrseite der Medaille: die "zusätzlichen" Jahre sind oft mit chronischen Erkrankungen, Schmerzen und einem Verlust an Fähigkeiten verbunden. Zu diesen Defekten trägt auch der jeweilige Lebensstil maßgeblich bei. Ein besonderes Problem ist dabei die mit dem Lebensalter weltweit steigende Tendenz an Demenz zu erkranken (Abbildung 1). In allen untersuchten Regionen ist dabei die Zugehörigkeit zum weiblichen Geschlecht mit einem erhöhten Demenz-Risiko verbunden: von den über 90-jährigen Frauen in SO-Asien, N-Amerika und insbesondere Lateinamerika sind über 50 % von Demenz betroffen.
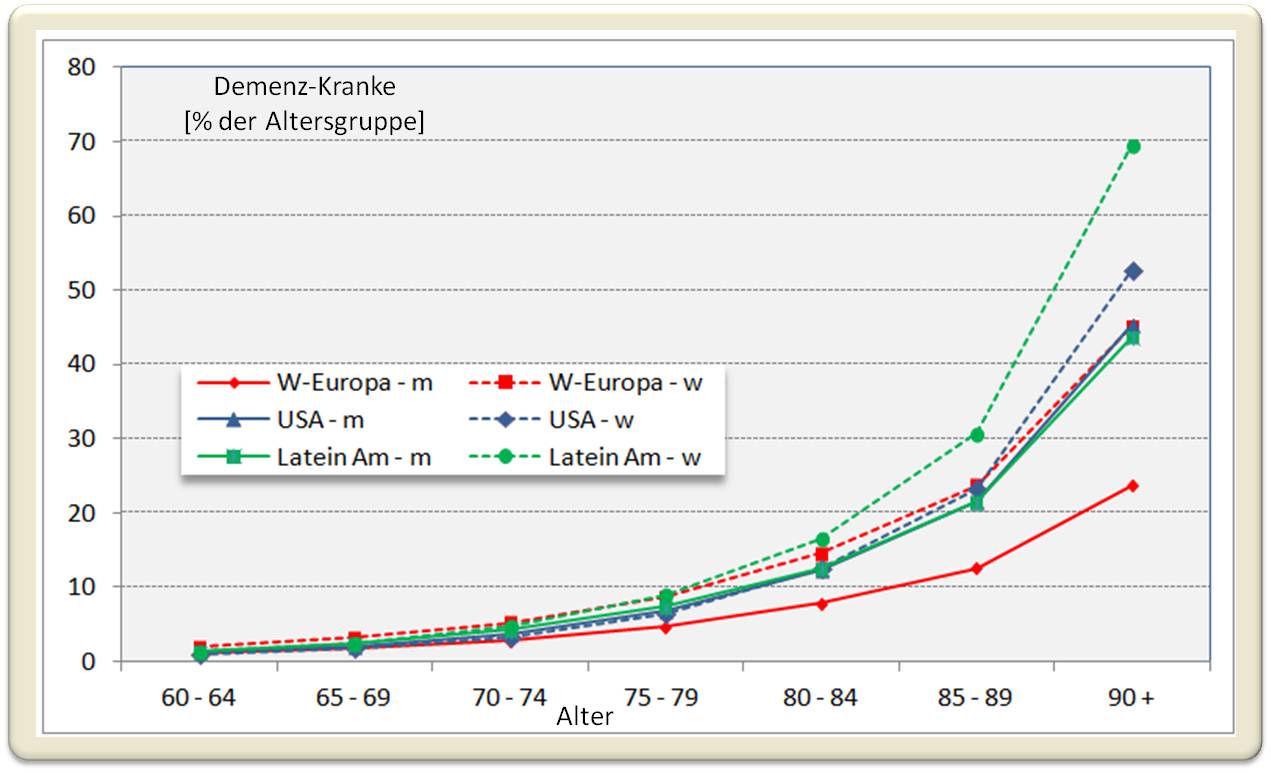 Abbildung 1. Die Häufigkeit der Demenzerkrankungen nach Altersgruppen und Geschlecht (m, w). Daten aus: World Alzheimer Report 2015. The Global Impact of Dementia[4]
Abbildung 1. Die Häufigkeit der Demenzerkrankungen nach Altersgruppen und Geschlecht (m, w). Daten aus: World Alzheimer Report 2015. The Global Impact of Dementia[4]
Wie viele Demenzerkrankte gibt es?
Aktuelle Schätzungen gehen davon aus, dass weltweit 46,8 Millionen Menschen an Demenz leiden und, dass deren Zahl 2030 bereits auf 74,5 und 2050 auf 131,5 Millionen angestiegen sein wird [3]. In Österreich gibt es etwa 100.000 Demenz-Kranke, bis 2050 rechnet man mit einem Anstieg auf etwa 230.000 [5]. In Deutschland leben nach Schätzungen der Deutschen Alzheimer Gesellschaft derzeit etwa 1,5 Millionen Demenzkranke, bis 2050 wird diese Zahl auf rund 3 Millionen ansteigen.
Neben dem physischen und psychischen Leid der Betroffenen und deren Betreuer, die in den späteren Phasen der Erkrankung ja die Patienten versorgen und ihnen in allen Verrichtungen des täglichen Lebens Hilfestellung leisten müssen, kommen auch die sozialen und ökonomischen Konsequenzen zum Tragen. Global rechnet man für das Jahr 2018 mit Kosten von 1 000 Mrd US $ [4]. In Österreich waren es 2014 rund 1 Mrd €, die zum überwiegenden Teil für nicht-medizinische Leistungen ausgegeben wurden.
Der Großteil der Demenz-Fälle, nämlich 60 - 70 %, sind auf die Alzheimer-Krankheit zurückzuführen.
Was ist die Ursache der Alzheimer-Krankheit?
In ihrem, im April 2016 herausgegebenen Factsheet schreibt die WHO:
"Derzeit ist keine Therapie verfügbar, die Demenz heilen oder ihr Fortschreiten verzögern könnte. Zahlreiche neue Behandlungsmöglichkeiten werden in den verschiedenen Phasen der klinischen Testung untersucht"[6].
Tatsächlich wird seit Jahrzehnten intensiv nach wirksamen Medikamenten gegen Alzheimer gesucht. Diese Forschungen richt(et)en sich im Wesentlichen auf eine Reduktion der unlöslichen Proteinablagerungen, welche die Krankheit charakterisieren, nämlich die beta-Amyloid Plaques außerhalb und die verklumpten Tau-Protein Fibrillen innerhalb der Nervenzellen des Gehirns. Bis jetzt blieb dieser Suche der Erfolg versagt. Der US-amerikanische Forscher Dale E. Bredesen, ein international anerkannter Experte auf dem Gebiet der Neurodegeneration, geht von einem anderen Ansatz aus. (Bredesen ist Leiter des Mary S. Easton Center for Alzheimer's Disease Research, University of California, Los Angeles (UCLA) und Gründungsdirektor und CEO des Buck Institute for Age Research, Novato, CA).
Bredesen versucht die Krankheit zu verstehen. Er fragt nach der Chemie, welche die veränderten Fähigkeiten des Lernens und Erinnerns bewirkt, wendet die modernsten Methoden der Molekularbiologie und Informatik an. Basierend auf seinen Forschungsergebnissen postuliert er, dass Störungen nicht eines einzelnen Stoffwechselweges sondern erst mehrerer Wege zur Entstehung von Alzheimer führen. Die bis jetzt versuchten Monotherapien, die auf ein einziges definiertes Biomolekül, einen einzigen Mechanismus abzielten, mussten seiner Meinung nach deshalb erfolglos bleiben.
Vereinfacht und kurz dargestellt: Bredesen charakterisiert Alzheimer als einen metabolischen Defekt, als eine Störung im Stoffwechselnetzwerk der Nervenzellen und eine Vielfalt an Modulatoren, die diese Störung beeinflussen können. Im Gegensatz zur gegenwärtigen Anschauung, dass Alzheimer durch die Ablagerung unlöslicher, toxischer Proteinplaques bewirkt wird, postuliert Bredesen, ein Ungleichgewicht der von den Nervenzellen ausgehenden Signalwege als Ursache:
Während Nervenzellen in einem normal funktionierenden Hirn laufend neue Erinnerungen speichern und dafür irrelevante Erinnerungen löschen, kann diese Balance zwischen Bildung neuer Nervenverbindungen -Synapsen - ("synaptoblastische Aktivität") versus Abbau bestehender Synapsen ("synaptoclastische Aktivität") mit zunehmendem Alter in Richtung Abbau verschoben werden. Erinnerungen werden dann gelöscht, neue Inhalte nicht mehr gespeichert.
Bildung von Synapsen < Abbau von Synapsen
Das in der Alzheimer Krankheit Plaque-bildende Amyloid-beta-Peptid hat im normalen Hirn eine essentielle Funktion, nämlich in dem Gleichgewicht zwischen Bildung und Abbau das "Löschen" von Synapsen einzuleiten. Der Vorläufer des Peptids, das Amyloid-Precursor-Protein APP, übt hier mit seinen Spaltprodukten eine physiologische Schalterfunktion aus. Eine Vielzahl an Faktoren kann diese Balance modulieren, ihr Mangel oder Überschuss kann das Gleichgewicht stören. Es sind viele, für Alzheimer bereits bekannte Risikofaktoren, die hier eingreifen: das Apolipoprotein E4, Hormone wie Östradiol, Testosteron, Thyronin/Thyroxin, Melatonin, körperliches Training, Schlaf, u.v.a.m.
Eine gesteigerte Bildung des Amyloid-beta Peptids führt zur Verlagerung des Gleichgewichts in Richtung Abbau von Nervenverbindungen.
Paradigmenwechsel in der Alzheimertherapie - die MEND Strategie
Ausgehend von dem gestörten Stoffwechsel-Gleichgewicht der Nervenzellen und dessen Modulierung durch unterschiedlichste Effektoren hat Bredersen eine neuen Ansatz zur Alzheimer Therapie entwickelt, den er " metabolic enhancement for neurodegeneration (MEND)" nennt.
Es ist ein systembiologischer Ansatz.
Ein Dach mit 36 Löchern
Aus seinen Untersuchungen hat Bredesen 36 hauptsächliche Faktoren (inklusive beta Amyloid) identifiziert, die zum Ungleichgewicht zwischen synaptoblastischen und synaptoklastischen Prozessen führen, dieses verstärken können. Eine Therapie, welche die Optimierung nur eines oder nur weniger dieser Ursachen anpeilt, hält Bredesen für wenig sinnvoll:
Er erklärt Demenz mit der Metapher eines Daches, das 36 Löcher aufweist: Eine Monotherapie, also das Abdichten eines Loches wird das darunterliegende Gebäude kaum vor einem starken Regen schützen können.
Um Demenz zielführend zu behandeln, ist es also notwendig möglichst viele - 10, 20 und mehr - dieser 36 Löcher zu schließen. Um welche es sich dabei handelt, ist individuell verschieden, basiert auf der Analyse einer Vielzahl an metabolischen Laborwerten und deren Einfluss auf das Stoffwechselgleichgewicht der Nervenzellen. Es wird dabei das genetische, metabolische, hormonelle Profil und Verhalten des Patienten berücksichtigt und daraus ein personenbezogenes therapeutisches Programm - "Therapeutic System 1" - erstellt, das vom Optimieren der Ernährung und deren Timing, über Stressreduktion, Optimieren von Schlafdauer und - Qualität, regelmäßigem körperlichen und geistigen Training bis hin zur Optimierung von Hormonspiegeln, Wachstumsfaktoren, Antioxidantien, Vitaminen u.a. reicht. Die physiologischen Auswirkungen der einzelnen Programmpunkte sind experimentell verifiziert. Insgesamt gesehen führen sie zu einer Änderung der Lebensführung, die auch bei anderen chronischen Erkrankungen positive Auswirkungen haben sollte.
Ein Durchbruch in der Alzheimer-Therapie
Die MEND-Strategie wurde bis jetzt an einer kleinen Gruppe von 10 Personen, Frauen und Männern im Alter von 49 - 74 Jahren, angewandt, die an Alzheimer im Frühstadium, am sogenannten MCI (Mild Cognitive Impairment), oder SCI (Subjective Cognitive Impairment) litten. Die Behandlungsdauer war 5 - 24 Monate und brachte ein beispiellos erfolgreiches Ergebnis: Alle Patienten, deren Angehörige und Kollegen berichteten von eindeutigen, anhaltenden kognitiven Verbesserungen, die auch objektiv in neuropsychologischen Tests bestätigt wurden. 6 Patienten, die zu arbeiten aufgehört hatten oder bereits große Schwierigkeiten in ihrem Beruf hatten, konnten wieder ihren Beruf ausüben oder verbesserten ihre Leistung. Quantitative MRI Analysen bei einem der Patienten zeigten, dass auch das anfänglich geschrumpfte Volumen des Hippocampus - des Lernzentrums im Gehirn - sich unter der Therapie dramatisch vergrößert hatte.
Fazit
Die Alzheimer Krankheit ist komplex und multifaktoriell, Monotherapien, die sich nur auf ein gestörtes Zielmolekül/einen defekten Mechanismus richteten, haben bis jetzt keinen therapeutischen Erfolg erbracht.
Wenn bislang auch nur wenige Patienten nach der MEND-Strategie behandelt wurden, zeigt der bislang beispiellose Erfolg, dass metabolische Prozesse die Treiber der Alzheimerkrankheit - zumindest in ihrer Frühform - sind. Der mit der Krankheit einhergehende Prozess des Abbaus kognitiver Fähigkeit konnte nicht nur nachhaltig aufgehalten, sondern erstmals umgekehrt werden.
Bei den Schlüsselfaktoren der MEND-Strategie, handelt es sich dabei um Faktoren, die von jedem angewandt werden können und die - abgesehen von ihrem Effekt auf den Stoffwechsel der Nervenzellen - insgesamt auch zu einem gesünderen Lebensstil führen.
Es ist offensichtlich, dass der, in diesen Pilot-Untersuchungen zutage tretende, Durchbruch nun in ausgedehnten klinischen Untersuchungen bestätigt werden muss. Das Problem dabei: die lange Behandlungsdauer und die kostspielige Testung und Beobachtung der Patienten vor, während und nach Ende der Untersuchung. Pharmazeutische Konzerne werden wohl kaum Interesse daran haben derartige, bis zu 1 Mrd US $ teure klinische Untersuchungen zu beginnen, wenn sie keine Möglichkeit zur Patentierung des Verfahrens zu haben. Überdies sind sie darauf ausgerichtet klinische Versuche mit einem einzigen, völlig definierten Entwicklungskandidaten und nicht mit einer Palette unterschiedlichster Faktoren zu unternehmen.
Derartige Untersuchungen müßten meiner Ansicht nach von großen nationalen und übernationalen Einrichtungen - wie beispielweise der WHO - in die Wege geleitet und finanziert werden.
[1] Dale E. Bredesen et al., Reversal of cognitive decline in Alzheimer’s disease. Aging, June 2016, 8: 1-9.
[ [2] Lebenserwartung, Stand: 2014. http://wko.at/statistik/eu/europa-lebenserwartung.pdf
[3] STATISTIK AUSTRIA, Volkszählungen, Statistik des Bevölkerungsstandes (erstellt am 14.06.2016) und http://www.statistik.at/web_de/presse/108135.html
[4] World Alzheimer Report 2015. The Global Impact of Dementia. An analysis of prevalence, incidence, cost and trends. https://www.alz.co.uk/research/WorldAlzheimerReport2015.pdf
[5] Österreichischer Demenzbericht 2014. http://www.bmg.gv.at/cms/home/attachments/6/4/5/CH1513/CMS1436868155908/...
[6] Dementia. Fact sheet, April 2016. http://www.who.int/mediacentre/factsheets/fs362/en/
Weiterführende Links
Reversal of Cognitive Decline. Vortrag von Dale E. Bredesen (at 56 th Annual Conference Am. College of Nutrition) Nov. 2015 Video 45:05 min. https://www.youtube.com/watch?v=QqQ_X3mD16U
STEM-Talk Episode 12 Dale Bredesen discusses the metabolic factors underlying Alzheimer’s Disease. Video 1:25:39 min. https://www.youtube.com/watch?v=HS7VZydS8HI
Relevante Artikel in Scienceblog.at
Francis S. Collins, 27.05.2016. Die Alzheimerkrankheit: Tau-Protein zur frühen Prognose des Gedächtnisverlusts. http://scienceblog.at/die-alzheimerkrankheit-tau-protein-zur-fr%C3%BChen....
Susanne Donner, 08.04.2016. Mikroglia: Gesundheitswächter im Gehirn. http://scienceblog.at/mikroglia-gesundheitsw%C3%A4chter-im-gehirn#.
Gottfried Schatz, 03.07.2015. Die bedrohliche Alzheimerkrankheit — Abschied vom Ich. http://scienceblog.at/die-bedrohliche-alzheimerkrankheit#.
