Eine neue Sicht auf Typ-1-Diabetes?
Eine neue Sicht auf Typ-1-Diabetes?Do, 30.03.2017 - 06:28 — Ricki Lewis 
![]() Einer eben erschienenen Untersuchung des Teams um B.Petersen (Universität Florida) zufolge, könnte es ein Umdenken hinsichtlich der Entstehung von Typ-1-Diabetes (T1D) geben. Demnach dürfte T1D nicht direkte Folge eines Autoimmundefekts sein und das Verfolgen des Glukosespiegels im Blut nicht der einzige Weg, um die Krankheit in den Griff zu bekommen [1]. Im Fokus steht ein neu entdecktes, bei Patienten im Übermaß vorhandenes Protein, das die Balance von Insulin und seinem Gegenspieler Glukagon in Richtung Glukagon verschiebt und so der Insulin Funktion entgegenwirkt. Die Genetikerin Ricki Lewis fasst hier die faszinierenden Ergebnisse zusammen, die neue Möglichkeiten für Diagnose und Therapie eröffnen dürften.*
Einer eben erschienenen Untersuchung des Teams um B.Petersen (Universität Florida) zufolge, könnte es ein Umdenken hinsichtlich der Entstehung von Typ-1-Diabetes (T1D) geben. Demnach dürfte T1D nicht direkte Folge eines Autoimmundefekts sein und das Verfolgen des Glukosespiegels im Blut nicht der einzige Weg, um die Krankheit in den Griff zu bekommen [1]. Im Fokus steht ein neu entdecktes, bei Patienten im Übermaß vorhandenes Protein, das die Balance von Insulin und seinem Gegenspieler Glukagon in Richtung Glukagon verschiebt und so der Insulin Funktion entgegenwirkt. Die Genetikerin Ricki Lewis fasst hier die faszinierenden Ergebnisse zusammen, die neue Möglichkeiten für Diagnose und Therapie eröffnen dürften.*
Etablierte Vorstellungen in den Wissenschaften lassen sich nur schwer ändern. Beispielsweise:
Proteine sind der Stoff aus dem Gene gemacht sind,
Gene bestehen aus einem zusammenhängenden, immobilen Stück DNA,
das Genom besteht aus 120 000, nein, 80 000, nein 60 000 und schließlich aus 20325 Genen.
Sobald wir mehr in Erfahrung bringen, ändert sich unser Wissen über die Natur. Deshalb gibt es auch keinen strengen wissenschaftlichen Beweis, gerade eben Hinweise, Hypothesen und (selten) ausreichende Befunde um eine Theorie zu untermauern. Wissenschaft ist evidenzbasiert, beruhend auf Beobachtungen und Untersuchungen. Wir glauben nicht an die Evolution oder an den Klimawandel so als ob es eine Religion wäre. Dennoch kann es für einen Forscher schwierig sein Befunde aufzuzeigen, die eine gängige Vorstellung in Frage stellen.
In der Situation gegen ein Dogma anzutreten, befindet sich Bryon Petersen, Direktor des Pediatric Stem Cell Research and Hepatic Disorders Child Health Research Institute an der Universität von Florida. Seine Befunde lassen darauf schließen, dass Typ 1 Diabetes (T1D) nicht direkt aus einem Autoimmundefekt entstehen dürfte und, dass das Verfolgen des Glukosespiegels im Blut nicht der einzige Weg wäre, um die Krankheit in den Griff zu bekommen.
Mit seinem Team hat Petersen eben eine Arbeit veröffentlicht, die ein wenig bekanntes Protein, das Islet Homeostasis Protein (IHoP), in den Fokus rückt [1]:
Menschen, die an Typ 1 Diabetes leiden erzeugen zu viel von diesem IHoP. Untersuchungen an Mäusen und Menschen zeigen, dass eine Reduzierung von IHoP die Regulierung des Glukosespiegels im Blut wiederherstellt und die Zahl der Insulin-produzierenden beta-Zellen in der Bauchspeicheldrüse (dem Pankreas) erhöht. Der vielleicht wichtigste Befund: ein Übermass an IHoP im Blut der Patienten, das es zu einem möglichen neuen Biomarker für T1D macht.
Zur Anatomie des Pankreas
Das Pankreas ist eine zweifache Drüse: Der exokrine Teil erzeugt Enzyme zur Spaltung von Proteinen, Lipiden und Stärke und setzt diese in die Verdauungsflüssigkeit im Dünndarm frei.
Dies ist für Diabetes nicht von Bedeutung. Der endokrine (d.i. Hormon-erzeugende) Teil besteht aus Anhäufungen von Zellen, die als Inseln (Langerhans-Inseln) bezeichnet werden, wobei eine derartige Insel vier unterschiedliche Zelltypen beherbergt . 15 - 20 % der Inselzellen sind sogenannte alpha-Zellen, die Glukagon freisetzen (Abbildung 1). Dieses Hormon steigert den Glukosespiegel im Blut indem es in der Leber den Abbau der Speicherform Glykogen stimuliert und die Neusynthese von Glukose aus Aminosäuren.
Rund 60 % der Inselzellen sind sogenannte beta-Zellen, die ein anderes Hormon - Insulin - produzieren (Abbildung 1). Insulin ist der Gegenspieler zu Glukagon: es stimuliert die Leber Glukose zu Glykogen aufzubauen und verhindert dass andere Nährstoffe in Glukose umgewandelt werden. Zellen, die Rezeptoren für Insulin besitzen, werden durch das Hormon zur Aufnahme von Glukose aus dem Blutstrom stimuliert. Dies ist der Grund warum Training dazu führt, dass die Muskel (Skelettmuskel) Glukose aufnehmen und damit seinen Blutspiegel senken - ein den Diabetikern wohlbekannter Effekt.
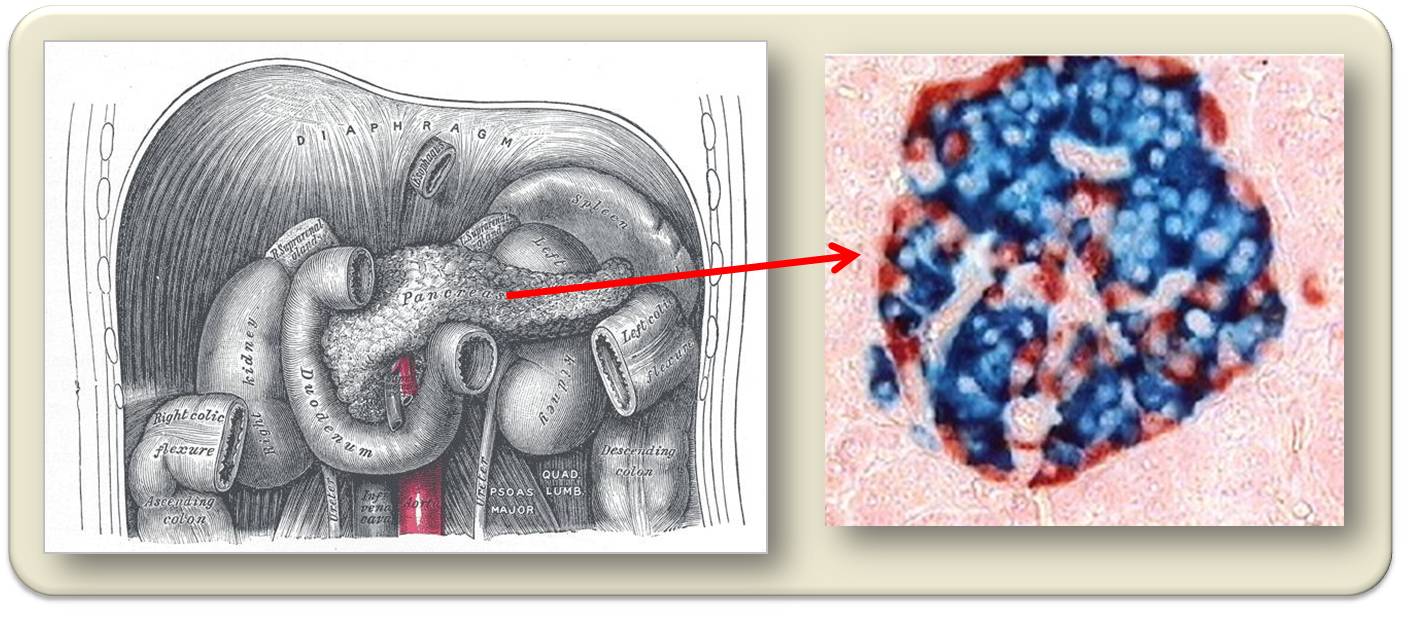 Abbildung 1. Das Pankreas im Bauchraum und eine mikroskopische Aufnahme der Anhäufung - Inseln - endokriner Zellen. Glukagon-produzierende alpha Zellen sind rot, Insulin erzeugende beta-Zellenblau.
Abbildung 1. Das Pankreas im Bauchraum und eine mikroskopische Aufnahme der Anhäufung - Inseln - endokriner Zellen. Glukagon-produzierende alpha Zellen sind rot, Insulin erzeugende beta-Zellenblau.
IHoP fördert die Glukagon Produktion - es wirkt damit der Funktion des Insulin entgegen. Wird im Tiermodell der diabetischen Mäuse die IHoP Produktion herunterreguliert (mittels RNA-Interferenz, auf die hier nicht eingegangen werden soll; Anm. Red), so normalisiert sich der Glukosespiegel in den Tieren.
In Patienten mit T1D enthalten die Inseln wesentlich mehr als 15 - 20 % alpha-Zellen, da die beta-Zellen absterben. Abbildung 2. Dies wird weithin als Trigger für Autoimmunangriffe angesehen, welche als primäre Auslöser der Krankheit betrachtet werden. Petersens Untersuchungen weisen nun darauf hin, dass Autoimmunität erst sekundär auftreten dürfte - dies kann wesentliche klinische Auswirkungen auf Diagnose, Überwachung und Behandlung der Krankheit haben.
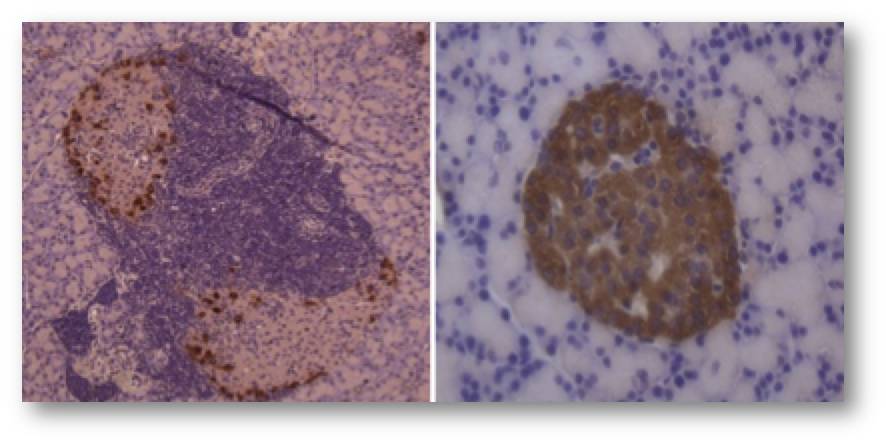 Abbildung 2. Vergleich der Insel eines T1D-Patienten (links) mit der Insel eines Gesunden (rechts). Die beta- Zellen sind braun gefärbt. Im linken Bild fehlen intakte beta-Zellen, nur zerstörte Reste sind vorhanden.
Abbildung 2. Vergleich der Insel eines T1D-Patienten (links) mit der Insel eines Gesunden (rechts). Die beta- Zellen sind braun gefärbt. Im linken Bild fehlen intakte beta-Zellen, nur zerstörte Reste sind vorhanden.
Ist Autoimmunität sekundär?
Gegen eine etablierte Meinung anzugehen hat - wie Petersen meint - dazu geführt, dass seine Untersuchung erst nach fünf Jahren angenommen wurde, nachdem eine lange Reihe von Top-Journalen diese abgelehnt hatten.
"Unsere Untersuchungen erregen bei den Diabetesforschern Aufregung, da IHoP nun Dinge deuten kann, die sie selbst nicht erklären konnten. T1D ist keine Autoimmunerkrankung" sagt Petersen.
Die Verbindung zwischen dem Anstieg von IHoP und der Autoimmun-Zerstörung der beta-Zellen könnte in der Ähnlichkeit des IHoP zu Plastin liegen, einem Protein, das dafür bekannt ist, dass es an das Zytoskelett von aktivierten T-Zellen bindet und diesen Beweglichkeit verleiht. Möglicherweise ist IHoP dazu ebenfalls in der Lage - dies gibt das Bild der Autoimmunität, da Aktivierung von T-Zellen ja Bestandteil der Immunantwort ist.
Wurde die Expression von IHoP in den Mäusen herunterreguliert, so konnten deren Inselzellen länger als 35 Wochen von schädigenden Immunzellen freigehalten werden. In Petersens Veröffentlichung findet sich diese Auswirkung in Form einer Waage dargestellt (Abbildung 3): Ein Anstieg von IHoP verändert das Gleichgewicht: Glukagon ist nun oben, Insulin unten - als Folge entsteht Diabetes. Wird IHoP stillgelegt, kommt die Schaukel ins Gleichgewicht. Allerdings muss eine derartige Blockierung schon früh im Krankheitsprozess erfolgen, um die Zerstörung von beta-Zellen zu stoppen sodass das Pankreas sich rechtzeitig noch erholen und die Insulin Produktion wieder aufnehmen kann.
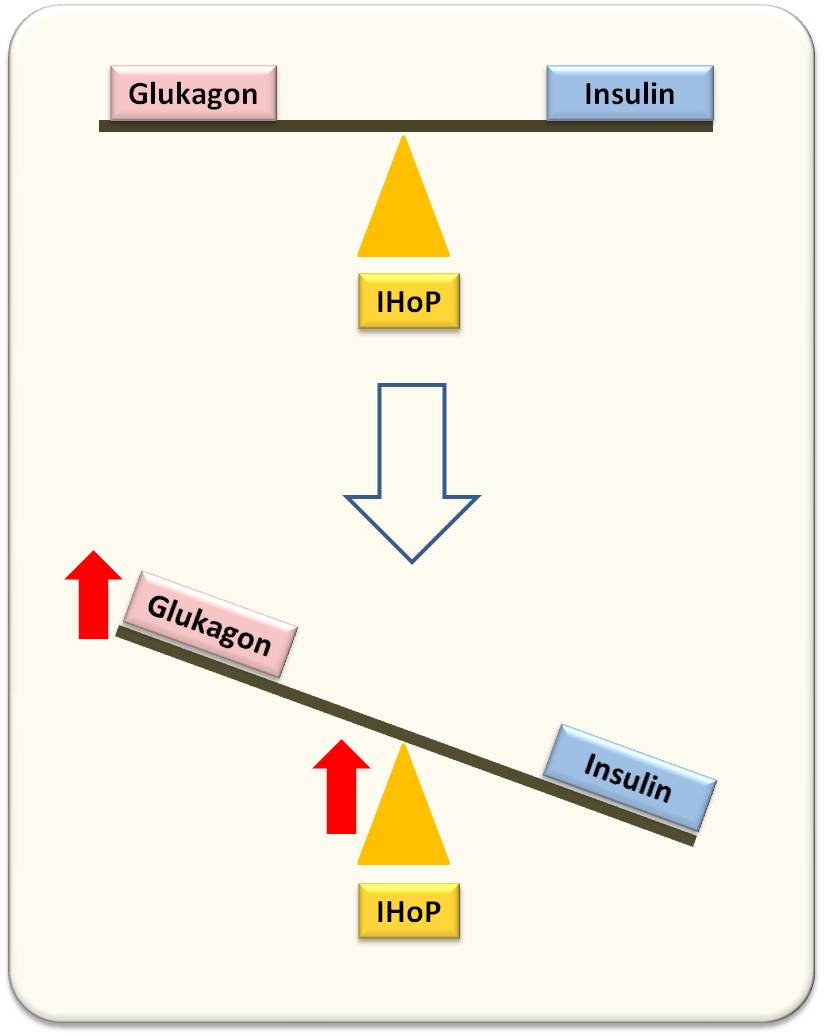 Abbildung 3. In gesunden pankreatischen Inseln sind Glukagon und Insulin balanciert (oben). Bei T1D (unten) wird IHoP verstärkt exprimiert, das die Glukagon-Produktion stimuliert; Insulin sinkt ab.
Abbildung 3. In gesunden pankreatischen Inseln sind Glukagon und Insulin balanciert (oben). Bei T1D (unten) wird IHoP verstärkt exprimiert, das die Glukagon-Produktion stimuliert; Insulin sinkt ab.
Das Ergebnis ist mehr als ein Abgehen von der traditionellen Betrachtung der T1D als eine Autoimmunerkrankung - es hat ein bedeutendes klinisches Potential. Petersen erklärt dies so:
"IHoP bewirkt Dreierlei: Erstens und vor allem öffnet es einen neuen Weg zum Verständnis der Krankheit. Zweitens haben wir damit ein neues Target in der Hand, um Arzneimittel/ Behandlungsformen für frisch diagnostizierte Patienten zu entwickeln. Drittens ergibt es für das Gebiet eine neuen Biomarker, der eine frühere Diagnose und damit bessere therapeutische Chancen ermöglicht."
Petersen räumt jedoch ein, dass unser Wissen über Autoimmunität noch recht beschränkt ist, eine - wie er es nennt - unglückselige Konstellation von abweichenden Immunantworten, in denen sich der Organismus gegen seine eigenen gesunden Zellen und Organe richtet und häufig in Krankheit endet. "Es ist eine fehlgeleitete Immunantwort, die möglicherweise aber nicht in einer zufallsbedingten Weise abläuft. Vielleicht ist es nicht so sehr ein Angriff auf das "Selbst", sondern eine Sekundärreaktion auf einen Vorgang, der zur Aktivierung von Antigen-präsentierenden Zellen führt, damit eine T-Zell Antwort auslöst und so den Eindruck von Autoimmunität vermittelt."
Fazit
Diabetes ist ein wesentliches Kapitel in der Geschichte der Medizin: es geht aus von Versuchen, die Frederick Banting und Charles Best (Universität Toronto) in den frühen 1920er Jahren an Hunden ausführten und dabei das ursprünglich "Isletin" genannte Hormon entdeckten und führt über Insulin-Pumpen und Insel-Transplantationen vierzig Jahre später bis zum ersten, mittels rekombinanter DNA-Technologie hergestellten Therapeutikum, 60 Jahre danach.
Möglicherweise wird mit IHop das nächste Kapitel in der Geschichte von Typ1 Diabetes aufgeschlagen.
*Der Artikel ist erstmals am 23. März 2017 in PLOS Blogs - DNA Science Blog unter dem Titel "A New View on Diabetes?" erschienen (http://blogs.plos.org/dnascience/2017/03/23/a-new-view-of-diabetes/) und steht unter einer cc-by Lizenz . Die Autorin hat sich freundlicherweise mit der Übersetzung ihrer Artikel durch ScienceBlog.at einverstanden erklärt. Die Übersetzung folgt so genau wie möglich der englischen Fassung. Von der Redaktion eingefügt: Beschriftung der Abbildungen, Untertitel.
[1] S-H Oh, ML Jorgensen, CH Wasserfall, A Gjymishka, BE Petersen. Suppression of islet homeostasis protein thwarts diabetes mellitus progression. Laboratory Investigation (2017), 1–14. http://www.nature.com/labinvest/journal/vaop/ncurrent/pdf/labinvest201715a.pdf
Weiterführende Links
Über Typ1 Diabetes (englisch): Type 1 Diabetes Facts. http://www.jdrf.org/about/fact-sheets/type-1-diabetes-facts/
Diabetes (Typ 2) im ScienceBlog
- Hartmut Glossmann 10.03.2015: Metformin – vom Methusalem unter den Arzneimitteln zur neuen Wunderdroge?
- Jens Brüning & Martin Hess 17.04.2015: Veranlagung zu Übergewicht: ein Wechselspiel von Genom und Umwelt?